
【題目】對于反應COCl2(g) ![]() CO(g)+Cl2(g) ΔH>0。改變下列條件,能加快反應速率,且CO的物質的量分數增大的是
CO(g)+Cl2(g) ΔH>0。改變下列條件,能加快反應速率,且CO的物質的量分數增大的是
A. 恒容下通入He B. 恒容下增大COCl2的濃度
C. 加催化劑 D. 升溫
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的幾種。①若加入鋅粒,產生無色無味的氣體;②若加入NaOH溶液,產生白色沉淀,且產生的沉淀量與加入NaOH的物質的量之間的關系如下圖所示。則下列說法正確的是( )
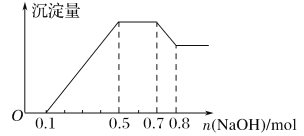
A. 溶液中的陽離子只有H+、Mg2+、Al3+
B. 溶液中n(NH4+)=0.2mol
C. 溶液中一定不含CO32-,可能含有SO42-和NO3-
D. n(H+)∶n(Al3+)∶n(Mg2+)=1∶1∶1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】今將Fe16.8g加入到1L濃度為nmol/L的稀硝酸溶液中(假定硝酸還原產物只NO)充分反應后,Fe和HNO3均無剩余,n不可能為
A. 0.6B. 0.8C. 1.0D. 1.2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上常用如下的方法從海水中提碘:
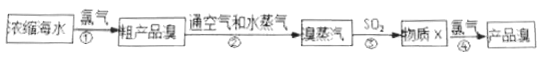
完成下列填空:
(1)上述流程中有兩步都涉及到氯氣。寫出氯元素在周期表中的位置:_________;
氯氣分子中所含的化學鍵名稱是:_________;在![]() 原子鐘,其核外存在_________種運動狀態不同的電子。
原子鐘,其核外存在_________種運動狀態不同的電子。
(2)和氯元素位于同主族的另外一個短周期元素單質的電子式是:_________,
兩者氣態氫化物的穩定性是:_________>_________(填寫化學式)。
(3)步驟②中體現了溴具有的性質是_______________(文字簡述)。
(4)寫出步驟③中反應的化學方程式(說明:此反應在水溶液中進行):________________;在該反應中被氧化的元素是:_________。
(5)工業上利用海水還有一個重要的反應就是電解飽和食鹽水,此反應中的陰極產物是:_________和_________(寫化學式)。
(6)溴蒸汽還可以用飽和碳酸鈉溶液來吸收,產物為溴化鈉、溴酸鈉,同時放出二氧化碳,請寫出該反應的化學方程式并標明電子轉移方向與數目:______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知四種短周期元素A、B、C、D的原子序數依次增大,其中A元素的原子只有一個電子層,又知A與C、B與D分別是同一主族的元素,B、D兩元素原子的質子數之和是A、C兩元素原子的質子數之和的二倍。請回答下列問題。
(1)由A、B兩種元素可形成E、F兩種化合物,寫出其中一種化合物分解生成另一種化合物的化學方程式:_________________________,反應物的電子式是_________,其所含化學鍵為(選代碼)___________。
a.離子鍵 b.極性共價鍵 c.非極性共價鍵
(2)以上四種元素中的部分元素之間形成的化合物,能使品紅溶液褪色的物質有_______________(填化學式)。
(3)由A、B、C、D四種元素組成的化合物甲和乙,它們水溶液相互反應的離子方程式為_______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】四種短周期元素在周期表中的位置如下圖,其中只有Z為金屬元素。下列說法不正確的是( )
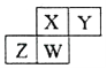
A. 原子半徑W>Y
B. X的最簡單氣態氫化物的熱穩定性比W的小
C. Z元素的氧化物既能與強酸反應又能與強堿反應
D. Y的氫化物能與其最高價含氧酸反應生成離子化合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】近幾年我國大面積發生霧霾天氣,其主要原因是SO2、NOx、揮發性有機物等發生二次轉化,研究碳、氮、硫及其化合物的轉化對于環境的改善有重大意義。
(1)在一定條件下,CH4可與NOx反應除去NOx,已知有下列熱化學方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ·mol-1
②N2(g)+2O2(g)![]() 2NO2(g) △H=+67.0 kJ·mol-1
2NO2(g) △H=+67.0 kJ·mol-1
③H2O(g)=H2O(l) △H=-41.0 kJ·mol-1
則CH4(g)+2NO2(g)![]() CO2(g)+2H2O(g)+N2(g) △H=_____;
CO2(g)+2H2O(g)+N2(g) △H=_____;
(2)某研究小組用NaOH溶液吸收尾氣中的二氧化硫,將得到的Na2SO3溶液進行電解,其中陰陽膜組合電解裝置如圖一所示,電極材料為石墨。
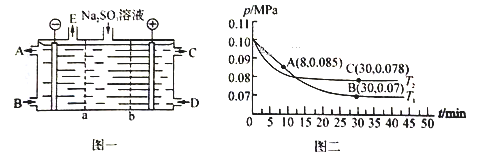
① b表示_____離子交換膜(填“陰”或“陽”)。A—E分別代表生產中的原料或產品。其中C為硫酸,則A表示______________。
②陽極的電極反應式為______________________________________。
(3)SO2經過凈化后與空氣混合進行催化氧化可制取硫酸,其中SO2發生催化氧化的反應為: 2SO2(g)+O2(g)![]() 2SO3(g)。若在T1℃、0.1 MPa條件下,往一密閉容器通入SO2和O2〔其中n(SO2):n(O2)=1:1〕,測得容器內總壓強與反應時間如圖二所示。
2SO3(g)。若在T1℃、0.1 MPa條件下,往一密閉容器通入SO2和O2〔其中n(SO2):n(O2)=1:1〕,測得容器內總壓強與反應時間如圖二所示。
①圖中A點時,SO2的轉化率為________。
②在其他條件不變的情況下,測得T2℃時壓強的變化曲線如圖所示,則C點的正反應速率v0(正)與A點的逆反應速率vA(逆)的大小關系為vA(逆)_____ v0(正) (填“>” “<”或“ = ”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,用NaOH溶液滴定H2C2O4溶液,溶液中-1g[c(H+)/c(H2C2O4)]和-1gc(HC2O4-)或-1g[c(H+)/c(HC2O4-)]和-1gc(C2O42-)關系如圖所示,下列說法不正確的是
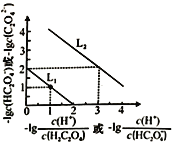
A. 曲線L1表示-1g[c(H+)/c(H2C2O4)]和-1gc(HC2O4-)的關系
B. Ka2(H2C2O4)的數量級為10-2
C. 已知 NaHC2O4溶液的pH<7,則溶液中c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4)
D. 向0.1mol/L H2C2O4溶液中加入少量水[c(HC2O4-)/c(H2C2O4)]增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】無水四氯化錫(SnCl4)常用作有機合成的氯化催化劑。實驗室可用熔融的錫(熔點231.9℃)與Cl2反應制備SnCl4,裝置如圖所示。回答下列問題:
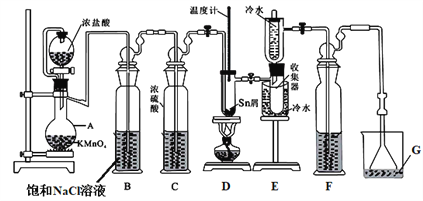
已知:①SnCl4在空氣中極易水解生成SnO2·хH2O
②
物質 | 顏色、狀態 | 熔點/℃ | 沸點/℃ |
SnCl2 | 無色晶體 | 246 | 652 |
SnCl4 | 無色液體 | -33 | 114 |
(1)儀器A的名稱是_______________。
(2)Cl2 和錫的反應產物有SnCl4和SnCl2,為防止產品中帶入過多的SnCl2,可采取的措施是_____________________________________。
(3)設置試劑F的目的是_______________。
(4)碘氧化法滴定分析產品中2價Sn(II)的含量。準確稱取m g產品于錐形瓶中,用蒸餾水溶解,淀粉溶液做指示劑,用c mol·L-1 碘單質標準溶液滴定至終點,消耗碘標準溶液V mL,計算產品中Sn(II)的含量______(用含c、m、V的代數式表示)。
(5)某實驗小組甲欲證明由A裝置產生的氣體中確實含有HCl,設計了如下實驗裝置。
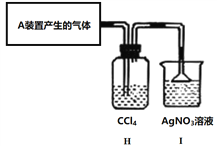
乙小組認為,不能確定進入I裝置的氣體只有一種。經過充分討論,乙小組認為可以在不改動裝置的前提下,僅替換一種試劑,即可完成論證。請給出改動方案:_____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com