
【題目】NH3作為一種重要化工原料,被大量應用于工業生產,與其有關性質反應的催化劑研究曾被列入國家863計劃。
(1)催化劑常具有較強的選擇性,即專一性。已知:
反應I:4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
反應II:4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1
2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1
寫出NO分解生成N2與O2的熱化學方程式_____。
(2)在恒溫恒容裝置中充入一定量的NH3和O2,在某催化劑的作用下進行反應I ,測得不同時間的NH3和O2,的濃度如下表:
時間(min) | 0 | 5 | 10 | 15 | 20 | 25 |
c(NH3)/mol·L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0.072 | 0.072 |
c(O2)/mol L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
則下列有關敘述中正確的是_____________。
A.使用催化劑時,可降低該反應的活化能,加快其反應速率
B.若測得容器內4v正(NH3) =6v逆(H2O)時,說明反應已達平衡
C.當容器內![]() =1時,說明反應已達平衡
=1時,說明反應已達平衡
D.前10分鐘內的平均速率v( NO)=0.088 mol·L-1·min-1
(3)氨催化氧化時會發生上述兩個競爭反應I、II。為分析某催化劑對該反應的選擇性,在1L密閉容器中充入1 mol NH3和2mol O2,測得有關物質的量關系如下圖:

①該催化劑在低溫時選擇反應_______(填“ I ”或“ II”)。
②52℃時,4NH3+3O2![]() 2N2+6H2O的平衡常數K=_______(不要求得出計算結果,只需列出數字計算式)。
2N2+6H2O的平衡常數K=_______(不要求得出計算結果,只需列出數字計算式)。
③C點比B點所產生的NO的物質的量少的主要原因________。
(4)制備催化劑時常產生一定的廢液,工業上常利用氫硫酸檢測和除去廢液中的Cu2+。
已知:25℃時,K1(H2S) =1.3×10-7,K1(H2S) =7.1×10-15,Ksp(CuS) =8.5×10-45
①在計算溶液中的離子濃度時,涉及弱酸的電離通常要進行近似處理。則0.lmol L-1氫硫酸的pH≈______(取近似整數)。
②某同學通過近似計算發現0.lmol L-1氫硫酸與0.0lmol L-1氫硫酸中的c(S2-)相等,而且等于_____mol·L-1
③已知,某廢液接近于中性,若加入適量的氫硫酸,當廢液中c(Cu2+) >_____ mol·L-1(計算結果保留兩位有效數字),就會產生CuS沉淀。
【答案】 2NO(g)![]() N2(g) +O2(g) △H= -180.8 kJ·mol-1 AD II
N2(g) +O2(g) △H= -180.8 kJ·mol-1 AD II ![]() 該反應為放熱反應,當溫度升高,平衡向左(逆反應)移動 4 7.1×10-15 1.2×10-30
該反應為放熱反應,當溫度升高,平衡向左(逆反應)移動 4 7.1×10-15 1.2×10-30
【解析】(1)已知:反應I :4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1,反應 II : 4NH3(g)+3O2(g)
4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1,反應 II : 4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1,根據蓋斯定律可知( II-I)÷2可得2NO(g) =O2+N2(g) ,△H=[(-1266.6 kJ·mol-1)-(-905.0 kJ·mol-1)]÷2 = △H= -180.8 kJ·mol-1,NO分解生成N2與O2的熱化學方程式為2NO(g)
2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1,根據蓋斯定律可知( II-I)÷2可得2NO(g) =O2+N2(g) ,△H=[(-1266.6 kJ·mol-1)-(-905.0 kJ·mol-1)]÷2 = △H= -180.8 kJ·mol-1,NO分解生成N2與O2的熱化學方程式為2NO(g)![]() N2(g) +O2(g) △H= -180.8 kJ·mol-1;
N2(g) +O2(g) △H= -180.8 kJ·mol-1;
(2)A.催化劑的使用,可降低該反應的活化能,加快其反應速率,故A正確;B.當6v正(NH3) =4v逆(H2O)時可說明反應已達平衡,故B錯誤;C.容器內![]() =1時,無法表明反應達到平衡,故C錯誤;D.前10分鐘內的平均速率v(NH3)=v( NO)=
=1時,無法表明反應達到平衡,故C錯誤;D.前10分鐘內的平均速率v(NH3)=v( NO)=![]() mol·L-1·min-1=0.088 mol·L-1·min-1,故D正確;答案為AD。
mol·L-1·min-1=0.088 mol·L-1·min-1,故D正確;答案為AD。
(3)①由圖示可知低溫時,容器主要產物為N2,則該催化劑在低溫時選擇進行反應II;
② 4NH3(g) +5O2(g)![]() 4NO(g) +6H2O
4NO(g) +6H2O
變化物質的量濃度(mol/L) 0.2 0.25 0.2 0.3
4NH3+3O2![]() 2N2+6H2O
2N2+6H2O
變化物質的量濃度(mol/L) 0.4 0.3 0.2 0.6
平衡物質的量濃度(mol/L) 0.4 1.45 0.2 0.9
故520℃時4NH3+3O2![]() 2N2+6H2O的平衡常數K=
2N2+6H2O的平衡常數K=![]() ;
;
③ 已知4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1,正反應是放熱反應,當反應達到平衡后,溫度升高,平衡向左(逆反應)移動,導致NO的物質的量逐漸減小,即C點比B點所產生的NO的物質的量少;
4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1,正反應是放熱反應,當反應達到平衡后,溫度升高,平衡向左(逆反應)移動,導致NO的物質的量逐漸減小,即C點比B點所產生的NO的物質的量少;
(4)①多元弱酸電離時分步進行,但第一步是主要的,
H2S![]() H+ + HS-
H+ + HS-
起始物質的量濃度(mol L-1) 0.1 0 0
起始物質的量濃度(mol L-1) x x x
起始物質的量濃度(mol L-1) 0.1-x x x
則K1(H2S) =1.3×10-7≈![]() ,解得x≈1.3×10-4mol L-1,0.l mol L-1氫硫酸的pH≈4;
,解得x≈1.3×10-4mol L-1,0.l mol L-1氫硫酸的pH≈4;
②若0.lmol L-1氫硫酸與0.0lmol L-1氫硫酸中的c(S2-)相等,則可近似認為HS-的濃度和H+相等,此時K2(H2S) =[c(H+)c(S2-)]÷c(HS-)=7.1×10-15,c(S2-)=7.1×10-15
③溶液中c(S2-)為7.1×10-15mol·L-1,根據Ksp(CuS) =c(Cu2+) ×c(S2-)=8.5×10-45,可知c(Cu2+) =8.5×10-45÷7.1×10-15=1.2×10-30mol·L-1。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】水合堿式碳酸鎂[4MgCO3·Mg(OH)2·4H2O],又稱輕質碳酸鎂。常利用菱鎂礦(質量含量為碳酸鎂90%,碳酸鈣10%)碳化法制取:
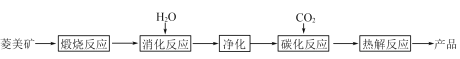
(1)根據下列表格數據,選擇消化反應的最佳溫度__________;理由是___________________________。
消化溫度/℃ | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
轉化率/% | 50.3 | 58.2 | 85.1 | 85.2 | 90.7 | 91.2 | 91.5 |
(2)碳化反應可生成Mg(HCO3)2,生成Mg(HCO3)2的化學方程式為____________。
(3)流程圖中__________和__________可以為碳化反應提供二氧化碳源。
(4)有工藝設計利用鹵水碳化法制取輕質碳酸鎂:
①鹵水中含有Fe2+和Mn2+,當其濃度小于1×10-5mol·L-1時,可以認為完全除去。常溫時當調節溶液PH為9.5時,此時Mn2+小于__________mol·L-1,不會沉淀出來。
物質 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
Ksp | 10-11 | 10-39 | 10-17 | 10-14 |
②如果把Fe2+轉化為Fe3+,從環境角度選擇最合適的氧化劑為__________。
A.Ca(ClO)2 B.Cl2 C.H2O2 D.HNO3
③下列方案中,較好的為__________,理由是______________________。
![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究碳、氮及其化合物的轉化對于環境的改善有重大意義。
(1)氧化還原法消除NOx的轉化如下:![]()
已知:NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9kJ/mol
2NO(g)+O2(g)=2NO(g) △H=-116.2kJ/mol
則反應I的熱化學方程式為________________。
(2)有人設想將CO按下列反應除去:2CO(g)=2C(s)+O2(g) △H>0,請你分析該設想能否實現?______(填“是”或“否”) ,依據是_____________。
(3)一定條件下,CO可與粉末狀的氫氧化鈉作用生成甲酸鈉。已知常溫時,甲酸的電離平衡常數Ka=1.70×10-4。
① 甲酸鈉的水溶液呈堿性,請用離子反應方程式表示其原因___________。
② 向20mL 0.1mol/L的甲酸鈉溶液中滴加10ml 0.1mol/L的鹽酸,混合液呈______性(填“酸”或“堿”),溶液中離子濃度從大到小的順序為______________。
(4)活性炭也可用于處理汽車尾氣中的NO。在2L恒容密閉容器中加入0.1000molNO和2.030mol固體活性炭,生成A、B兩種氣體,在不同溫度下測得平衡體系中各物質的物質的量如下表:
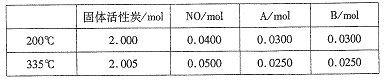
①該反應的正反應為________(填”吸熱”或“放熱”)反應。
② 200℃時,平衡后向恒容容器中再充入0.1molNO,再次平衡后,NO的百分含量將_____。(填“增大”、“減小”或“不變”)。
③計算反應體系在335℃ 時的平衡常數_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將NaCl溶液滴在一塊光亮清潔的鐵板表面上,一段時間后發現液滴覆蓋的圓周中心區(a)已被腐蝕而變暗,在液滴外沿形成棕色鐵銹環(b),如圖所示。導致該現象的主要原因是液滴之下氧氣含量比邊緣少。下列說法正確的是

A.液滴中的Cl― 由a區向b區遷移
B.液滴邊緣是正極區,發生的電極反應為:O2+2H2O+4e-![]() 4OH-
4OH-
C.液滴下的Fe因發生還原反應而被腐蝕,生成的Fe2+由a區向b區遷移,與b區的OH―形成Fe(OH)2,進一步氧化、脫水形成鐵銹
D.若改用嵌有一銅螺絲釘的鐵板,在銅鐵接觸處滴加NaCl溶液,則負極發生的電極反應為:Cu-2e-![]() Cu2+
Cu2+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】黑火藥是我國四大發明之一,黑火藥爆炸反應為:2KNO3+S+3C=K2S+N2↑+3CO2↑其中作為氧化劑的是
A. KNO3 B. C C. KNO3和S D. KNO3 和C
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】濃度均為0.10 mol/L、體積均為V0的MOH和ROH溶液,分別加水稀釋至體積V,pH隨![]() 的變化如圖所示,下列敘述錯誤的是( )
的變化如圖所示,下列敘述錯誤的是( )

A.MOH的堿性強于ROH的堿性
B.ROH的電離程度:b點大于a點
C.若兩溶液無限稀釋,則它們的c(OH-)相等
D.當lg![]() =2時,若兩溶液同時升高溫度,則
=2時,若兩溶液同時升高溫度,則 ![]() 增大
增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學生在化學晚會上表演如下魔術:用毛筆蘸取一種無色液體在一張白紙上書寫了“化學魔術”四字,然后再噴上一種無色液體,白紙上立即出現了紅色的“化學魔術”四字.該學生先后所用的無色液體可能是
A.石蕊溶液、稀硫酸 B.NaOH溶液、酚酞溶液
C.酚酞溶液、“雪碧”飲料 D.CuSO4溶液、NaOH溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】石灰石—石膏法脫硫是除去工業煙氣中所含SO2的重要方法,其工藝分為兩步: —是吸收產生亞疏酸氫鈣,二是氧化產生石膏。某校化學興趣小組實驗模擬該工藝,設計裝置如下:

(1)裝置B模擬產生含SO2的工業煙氣,則E裝置的作用是_______。
(2)實驗開始時,打開裝置B中分液漏斗的活塞,向燒瓶中逐滴滴加硫酸,D中立即產生了明顯的現象,造成產生這一現象的原因是__________。
A.該裝置的氣密性不夠好 B.滴加硫酸的速率較快
C.使用的硫酸濃度較小 D.石灰石漿液中碳酸鈣粉末的顆粒太小
(3)預計當裝置C中產生______的現象時,關閉裝置B中分液漏斗的活塞,再點燃裝置A處的酒精燈。實際實驗過程中卻始終未觀察到C中產生這一現象,小組成員多次逬行實驗探究,最終發現是藥品Na2SO3部分變質,請寫出定性實驗發現藥品Na2SO3問題的有關操作及現象:取少量的亞硫酸鈉固體于試管中,_____________。
(4)小組成員進一步定量實驗,測量Na2SO3的純度:
①稱取12.0 g Na2SO3固體配成l00 mL溶液,取25.00mL于錐形瓶中,并加入幾滴淀粉溶液。
②用0.1000 mol L-1酸性KIO3溶液滴定,三次平行實驗測得標準液的體積為20.00mL。則滴定終點時錐形瓶中產生的現象為_______,寫出與產生終點現象有關反應的離子方程式________,樣品中Na2SO3的質量分數為_________。(計算結果保留三位有效數字)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com