
【題目】燃煤煙氣中含有SO2和NOx(主要成分為NO和NO2的混合物),煙氣的脫硫、脫硝技術是環境科學研究的熱點。完成下列填空
(1)煙氣脫硫、脫硝的環境意義是________________________________。
(2)液相氧化法采用堿性NaClO2溶液作為吸收劑,如脫除NO的原理為:____NaOH + ____NaClO2 + ____NO → ____NaNO3 + ____NaCl + ____H2O配平上述化學方程式。該反應中被還原的元素是_______________。
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到較好的脫除效果。如脫除SO2的原理為:ClO- + SO2 + H2O=Cl-+ SO42- + 2H+。結合平衡移動原理分析使用Ca(ClO)2脫硫效果為何較NaClO更好?____。
【答案】防止酸雨的發生 4 3 4 4 3 2 Cl 形成CaSO4沉淀,降低硫酸根離子濃度,反應平衡向產物方向移動,SO2轉化率提高;
【解析】
(1)硫、氮的氧化物會污染空氣;
(2)根據電子守恒和元素守恒配平反應方程式;
(3)脫硫效果好即需要平衡右移,據此分析。
(1)煙氣脫硫、脫硝可以降低硫的氧化物、氮的氧化物含量,防止酸雨的發生,故答案為:防止酸雨的發生;
(2)該反應中Cl元素由+3價降到-1價,化合價降低被還原,做氧化劑,N元素由+2價升高到+5價,化合價升高被氧化,做還原劑,根據電子守恒和元素守恒可知方程式為:![]() ,故答案為:4;3;4;4;3;2;Cl;
,故答案為:4;3;4;4;3;2;Cl;
(3)①如果采用NaClO、Ca(ClO)2替代NaClO2,生成硫酸鈣沉淀,降低硫酸根離子濃度,促使平衡向正反應方向進行,所以Ca(ClO)2效果好,故答案為:形成CaSO4沉淀,降低硫酸根離子濃度,反應平衡向產物方向移動,SO2轉化率提高;


科目:高中化學 來源: 題型:
【題目】化合物 的分子式均為C5H8O2,下列說法正確的是( )
的分子式均為C5H8O2,下列說法正確的是( )
A.x分子中碳原子均位于同一平面
B.x、y均能與NaOH溶液發生反應
C.y、z均能與![]() 反應生成
反應生成![]()
D.與它們互為同分異構體的鏈狀羧酸有6種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列指定反應的離子方程式正確的是
A.將金屬鈉投入水中: Na+2H2O= Na+ +2OH-+H2↑
B.向AlCl3溶液中加入過量氨水: Al3+ +4NH3·H2O = AlO![]() +4NH
+4NH![]() +2H2O
+2H2O
C.向水中通入NO2: 2NO2+H2O= 2H++ NO![]() +NO
+NO
D.向Na2SiO3溶液中滴加稀鹽酸: SiO![]() +2H+ = H2SiO3↓
+2H+ = H2SiO3↓
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗現象與實驗操作不相匹配的是( )
A.將鎂條點燃后迅速伸入集滿![]() 的集氣瓶,集氣瓶中產生濃煙并有黑色顆粒產生
的集氣瓶,集氣瓶中產生濃煙并有黑色顆粒產生
B.向盛有![]() 溶液的試管中加過量鐵粉,充分振蕩后加1滴
溶液的試管中加過量鐵粉,充分振蕩后加1滴![]() 溶液,黃色逐漸消失,再加
溶液,黃色逐漸消失,再加![]() 后溶液顏色不變
后溶液顏色不變
C.將![]() 溶液加入
溶液加入![]() 溶液中,有白色沉淀生成,
溶液中,有白色沉淀生成,![]() 結合
結合![]() 的能力強于
的能力強于![]()
D.制取較高濃度的次氯酸溶液,將![]() 通入碳酸鈉溶液中
通入碳酸鈉溶液中
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溶液可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() ,某同學為確認其成分,設計并完成了如下實驗。由此可知原溶液中,下列有關說法正確的是( )
,某同學為確認其成分,設計并完成了如下實驗。由此可知原溶液中,下列有關說法正確的是( )
(![]() )
)
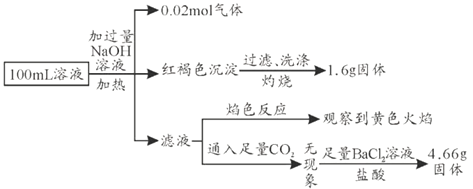
A.原溶液中![]()
B.![]() 、
、![]() 、
、![]() 一定存在,
一定存在,![]() 、
、![]() 一定不存在
一定不存在
C.溶液中至少有4種離子存在,其中![]() 一定存在,且
一定存在,且![]()
D.要確定原溶液中是否含有![]() ,其操作如下:取少量原溶液于試管中,滴加
,其操作如下:取少量原溶液于試管中,滴加![]() 溶液,紫紅色不消失
溶液,紫紅色不消失
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】掌握儀器名稱、組裝及使用方法是中學化學實驗的基礎,如圖為兩套實驗裝置。
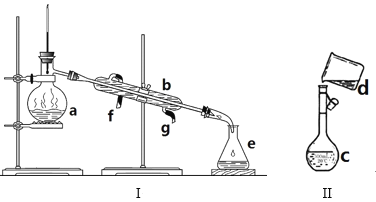
(1)寫出下列儀器的名稱:a、_____b、 _____
(2)若利用裝置I分離四氯化碳和酒精的混合物,還缺少的儀器是____,將儀器補充完整后進行實驗,溫度計水銀球的位置在____處。冷凝水由____(填f或g)口通入,___口流出。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關說法不正確的是
A.![]() 可表示單核10電子粒子基態時的電子排布
可表示單核10電子粒子基態時的電子排布
B.電子僅在激發態躍遷到基態時才會產生原子光譜
C.同一原子能層越高,s電子云的半徑越大
D.N、O、F電負性逐漸增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)據科技日報網報道,南開大學科研團隊借助鎳和苯基硼酸共催化劑,首次實現烯丙醇高效、綠色合成。烯丙醇及其化合物可制成甘油、醫藥、農藥、香料,合成維生素E和KI及天然抗癌藥物紫杉醇中都含有關鍵的烯丙醇結構。丙烯醇的結構簡式為CH2=CH-CH2OH。請回答下列問題:
①基態鎳原子的價電子排布圖為________。
②1 mol CH2=CH-CH2OH含有σ鍵的數目為________,烯丙醇分子中碳原子的雜化類型為___。
③Ni2+能形成多種配離子,如[Ni(NH3)6]2+、[Ni(CN)2]2- 和[Ni(SCN)2]- 等,與CN-互為等電子體的陰離子為_____。
(2)乙炔是有機合成工業的一種原料。工業上曾用CaC2與水反應生成乙炔。
①CaC2中C22-中碳與碳之間存在碳碳三鍵,C22-與O22+互為等電子體,O22+的電子式可表示為_______。
②乙炔與氫氰酸反應可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中σ鍵和π鍵數目比是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】最近科學家研制的一種新型“微生物電池”可以將污水中的有機物轉化為H2O和CO2,同時產生電能,其原理示意如圖。下列有關該電池的說法正確的是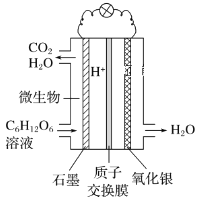
A.氧化銀電極上的反應為Ag2O+2e-=2Ag+O2-
B.石墨電極上的反應為C6H12O6+6H2O-24e-=6CO2↑+24H+
C.每轉移4 mol電子,石墨電極產生22.4 L CO2氣體
D.每30 g C6H12O6參與反應,有4 mol H+經質子交換膜進入負極區
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com