
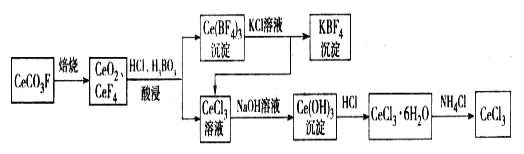
【題目】工業上利用氟碳鈰礦(主要成分CeCO3F)提取CeCl3的一種工藝流程如下:
請回答下列問題:
(1)CeCO3F中,Ce元素的化合價為_________。
(2)酸浸過程中可用稀硫酸和H2O2替換HCl,優點為____________;寫出稀硫酸、H2O2與CeO2反應的離子方程式:______________。
(3)寫出Ce(BF4)3中加入KCl溶液反應的離子方程式:__________。
(4)化學家研究發現,SbF5能將MnF4從離子[SbF6]2-的鹽反應得到,SbF5轉化成穩定離子[SbF6]-的鹽。而SbF4很不穩定,受熱易分解為SbF3和F2。根據據以上研究寫出以K2MnF6和SbF5為原料,在 423 K 的溫度下制備F2的化學方程式:______________________。
現代工業以電解熔融的氟氫化鉀(KHF2)和氟化氫(HF)混合物制備氟單質,電解制氟裝置如圖所示。 已知KHF2是一種酸式鹽,寫出陰極上發生的電極反應式_______。電解制氟時,要用鎳銅合金隔板將兩種氣體產物嚴格分開的原因是________。
(5)已知25 ℃時,HF的電離平衡常數Ka=3.6×10-4,CaF2的溶解積常數Ksp(CaF2)=1.46×10-10。現向1 L 0.2 mol/L HF溶液中加入 1 L 0.2 mol/L CaCl2 溶液,通過列式計算說明是否有沉淀產生:______________。
【答案】 +3 避免產生Cl2,不會造成環境污染 H2O2+2CeO2+6H+===2Ce3++4H2O+O2↑ Ce(BF4)3+3K+=== 3K BF4+Ce3+ 2K2MnF6+4SbF5![]() 4KSbF6+2MnF3+F2↑ 2HF
4KSbF6+2MnF3+F2↑ 2HF![]() +2e-===H2↑+4F- 氟氣和氫氣能發生劇烈反應,引發爆炸 c(H+)=c(F-)=
+2e-===H2↑+4F- 氟氣和氫氣能發生劇烈反應,引發爆炸 c(H+)=c(F-)=![]() mol·L-1=6×10-3mol·L-1,c(Ca2+)=0.1mol·L-1,c2(F-)·c(Ca2+)=3.6×10-5×0.1=3.6×10-6>1.46×10-10,該體系有CaF2沉淀。
mol·L-1=6×10-3mol·L-1,c(Ca2+)=0.1mol·L-1,c2(F-)·c(Ca2+)=3.6×10-5×0.1=3.6×10-6>1.46×10-10,該體系有CaF2沉淀。
【解析】本題考查物質制備工藝流程圖分析、離子方程式的書寫等、電解池、溶度積的應用等。
(1)根據化合物中元素化合價代數和為零可知,Ce元素在CeCO3F化合價為+3;(2)CeO2將鹽酸中Cl—氧化為Cl2,對環境產生污染;若改為稀硫酸和H2O2,CeO2在酸性條件下將中H2O2氧化為O2,避免產生Cl2,不會造成環境污染,其離子方程為 H2O2+2CeO2+6H+===2Ce3++4H2O+O2↑;(3)根據流程可知Ce(BF4)3中加入KCl生成KBF4沉淀和CeCl3溶液,故其離子反應方程式為:Ce(BF4)3+3K+=== 3KBF4+Ce3+;(4)結合題中信息“SbF5轉化成穩定離子[SbF6]-的鹽”和“SbF4很不穩定,受熱易分解為SbF3和F2”,故K2MnF6和SbF5為原料,在423 K 的溫度下制備F2的化學方程式為:2K2MnF6+4SbF5![]() 4KSbF6+2MnF3+F2↑;電解池陰極發生還原反應,化合價降低,電解池裝置圖可知,陰極產生氫氣,故陰極的電極反應式為:2HF
4KSbF6+2MnF3+F2↑;電解池陰極發生還原反應,化合價降低,電解池裝置圖可知,陰極產生氫氣,故陰極的電極反應式為:2HF![]() +2e-===H2↑+4F-;電解制氟時,陽極產生的氣體為F2,與陰極產生的氫氣能發生劇烈反應,在暗處就能爆炸,因此電解制氟時,要用鎳銅合金隔板將兩種氣體產物嚴格分開;(5)HF
+2e-===H2↑+4F-;電解制氟時,陽極產生的氣體為F2,與陰極產生的氫氣能發生劇烈反應,在暗處就能爆炸,因此電解制氟時,要用鎳銅合金隔板將兩種氣體產物嚴格分開;(5)HF![]() H++F—,由電離常數可知:c(H+)=c(F-)=
H++F—,由電離常數可知:c(H+)=c(F-)=![]() mol·L-1=6×10-3mol·L-1,混合液中:c(Ca2+)=
mol·L-1=6×10-3mol·L-1,混合液中:c(Ca2+)=![]() =0.1mol·L-1,c2(F-)·c(Ca2+)=3.6×10-5×0.1=3.6×10-6>1.46×10-10,該體系有CaF2沉淀。
=0.1mol·L-1,c2(F-)·c(Ca2+)=3.6×10-5×0.1=3.6×10-6>1.46×10-10,該體系有CaF2沉淀。


科目:高中化學 來源: 題型:
【題目】反應條件是影響有機化學反應的重要因素。下列各組物質的反應產物與反應條件無關的是
A. 甲苯與氯氣 B. 丙烯與溴的CCl4溶液
C. 溴乙烷與氫氧化鈉 D. 乙醇與濃硫酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.淀粉、纖維素和油脂都是天然高分子化合物
B.乙酸乙酯在堿性條件下的水解反應稱為皂化反應
C.乙醇能使酸性高錳酸鉀溶液褪色,發生的是氧化反應
D.乙烯可以與氫氣發生加成反應,苯不能與氫氣加成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關物質性質、用途的說法都正確的是
A. 硅晶體是良好的半導體,可用于制造光導纖維
B. 高壓鈉燈發出的黃光透霧能力強,可用于道路和廣場照明
C. 生石灰能與水反應,可用于除去CO2氣體中少量的水蒸氣
D. 碳酸鈉具有堿性,可用于治胃酸中和劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鈉及其化合物具有廣泛的用途。
(1)工業上制備碳酸氫鈉的化學方程式為____________。
(2)用Na2CO3熔融作電解質,CO、O2、CO2為原料可組成新型電池。該電池的結構如圖所示,正極的電極反應式為__________。

(3)常溫下,濃度均為0.1 mol·L-1的下列五種鈉鹽溶液的pH如下表:
溶質 | CH3COONa | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 11.6 | 10.3 | 11.1 |
上述鹽溶液的陰離子中,結合H+能力最強的是_______,根據表中數據,濃度均為0.01 mol·L-1下列四種酸的溶液分別稀釋100倍,pH變化最大的是_______(填序號)。
a.HCN b.HClO c.CH3COOH d.H2CO3
(4)實驗室中常用NaOH來進行尾氣處理、洗氣和提純。
①常溫下,當100 mL 2mol·L-1的NaOH溶液吸收4.48 L(折算成標準狀況)SO2時,所得溶液pH<7,則溶液中各離子濃度由大到小的順序為_______。
②常溫下,已知Ksp[Cu(OH)2]=2×10-20, Ksp[CuS]=1.3×10-36。向濃度為0.1mol/L,體積為10mL的氫氧化鈉溶液中,逐滴加入濃度為0.1mol/L 硫酸銅溶液至pH=6時Cu2+的濃度為______。向該溶液中滴入一滴0.1mol/L的硫化鈉溶液,_______(填“有”或“沒有”)CuS沉淀析出。(一滴約為0.05mL)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組物質中,第一種是電解質,第二種是分散系,第三種是合金的是 ( )
A. 硫酸、CuSO4·5H2O、生鐵 B. 酒精、空氣、銅綠
C. 二氧化碳、明礬、熟石灰 D. 硝酸鉀、食鹽水、黃銅
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用原電池原理除去廢水中的乙酸鈉和對氯酚(![]() ),其原理如圖所示,下列說法不正確的是
),其原理如圖所示,下列說法不正確的是

A. 電流方向從A極沿導線流向B極
B. 每轉移2mole-,有0.25mol CH3COO-被氧化
C. 當外電路中有2mole-轉移時,進入A極區的H+的個數為2NA
D. A極的電極反應式為![]()
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com