
【題目】如圖是模擬電化學反應的裝置圖,有關敘述正確的是
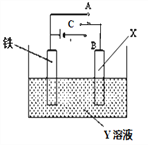
A. X為碳棒,Y為NaCl溶液,開關C置于A處,鐵棒表面 產生氣體
B. X為銅棒,Y為CuSO4溶液,開關C置于B處,鐵棒質量將減小,溶液中Cu2+濃度也減小
C. X為碳棒,Y為NaCl溶液,開關C置于B處,電子由負極流到鐵片,再由鐵片通過溶液流到碳棒,最后流回正極
D. X為鋅片,Y為NaCl溶液,開關C置于A處,鐵氧化速率增加
【答案】B
【解析】A.X為碳,Y為NaCl溶液,開關C置于A處,該裝置是原電池,鐵發生吸氧腐蝕,鐵棒上的電極反應式為:Fe-2e-=Fe2+,故A錯誤;B.X為銅棒,Y為CuSO4溶液,開關C置于B處,該裝置是電解池,鐵作陽極,陽極上發生的電極反應式為:Fe-2e-=Fe2+,陽極上質量減小,銅是陰極,陰極反應式為,Cu2++2e-=Cu,溶液中Cu2+濃度減小,故B正確;C.X為碳棒,Y為NaCl溶液,開關C置于B處,該裝置是電解池,電子由負極流到鐵片,再由碳棒流回正極,電子不進入電解質溶液,故C錯誤;D.X為鋅片,Y為NaCl溶液,開關C置于A處,鋅作負極,鐵作正極,鐵電極上得電子發生還原反應而被保護,則減緩鐵的腐蝕,故D錯誤;故選B。


 舉一反三單元同步過關卷系列答案
舉一反三單元同步過關卷系列答案科目:高中化學 來源: 題型:
【題目】用NA表示阿伏加德羅常數的值。下列敘述正確的是( )
A. 常溫常壓下,11.2L二氧化硫所含的氧原子數等于NA
B. 0.5molH2O所含的電子數為9NA
C. 8.0gCu2S和CuO的混合物中含有銅原子數為0.1NA
D. 300mL2mol·L-1蔗糖溶液中所含分子數為0.6NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CuSO4是一種重要的化工原料,有關制備途徑及性質如圖所示。下列說法錯誤的是
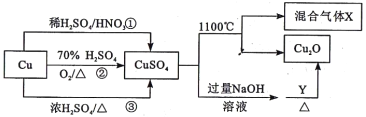
A. 途徑①所用混酸中H2SO4與HNO3物質的量之比最好為3:2
B. 生成等量的硫酸銅,三個途徑中參加反應的硫酸的物質的量: ①=②<③
C. 硫酸銅在1100℃分解的方程式為:2CuSO4![]() Cu2O+SO2↑+SO3↑+O2↑
Cu2O+SO2↑+SO3↑+O2↑
D. 當Y為葡萄糖時,葡萄糖發生還原反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】三室式電滲析法處理含Na2SO4廢水的原理如圖所示,采用惰性電極,ab、cd均為離子交換膜,在直流電場的作用下,兩膜中間的Na+和SO42-可通過離子交換膜,而兩端隔室中離子被阻擋不能進入中間隔室。下列敘述正確的是

A. 通電后中間隔室的SO42-離子向正極遷移,正極區溶液pH增大
B. 該法在處理含Na2SO4廢水時可以得到NaOH和H2SO4產品
C. 負極反應為2H2O–4e–=O2+4H+,負極區溶液pH降低
D. 當電路中通過1mol電子的電量時,會有0.5mol的O2生成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究性學習小組設計實驗探究鋁等金屬的性質:將鋁片(不除氧化膜)投入濃氯化銅溶液中,鋁表面很快出現一層海綿狀暗紅色物質,接下來鋁片上產生大量氣泡.觸摸容器知溶液溫度迅速上升,收集氣體,檢驗其具有可燃性.若用同樣的鋁片投入同濃度的硫酸銅溶液中,在短時間內鋁片無明顯變化.
(1)鋁與氯化銅溶液能迅速反應,而與同濃度的硫酸銅溶液在短時間內不反應的原因可能是________.
A.氯化銅溶液酸性比同濃度的硫酸銅溶液酸性強
B.硫酸銅水解生成硫酸使鋁鈍化
C.氯離子能破壞氧化鋁表面薄膜,而硫酸根離子不能
D.生成氯化鋁溶于水,而生成硫酸鋁不溶于水
請設計一個簡單實驗驗證你的選擇:________.
(2)鋁片表面出現的暗紅色物質的過程中發生的離子反應方程式是________. 用離子方程式解釋產生氣泡的原因:________.
(3)放出的氣體是________,請從有關物質的濃度、能量、是否有電化學作用等分析開始階段產生氣體的速率不斷加快的原因是________.(寫出一點即可)
(4)某同學通過一定的實驗操作,也能使鋁片與硫酸銅溶液反應加快,他采取的措施可能是________.
A.用砂紙擦去鋁片表面的氧化膜后投入硫酸銅溶液中
B.把鋁片投入熱氫氧化鈉溶液中一段時間后,取出洗滌,再投入硫酸銅溶液中
C.向硫酸銅溶液中滴加氫氧化鈉溶液,再投入鋁片
D.在鋁片上捆上幾枚銅釘后投入同濃度的硫酸銅溶液中
(5)除去氧化鋁的鋁片與銅片為電極,在X電解質溶液中構成原電池,列表如下:
選項 | 鋁電極 | 電解質 | 負極反應 | 正極反應 |
A | 正極 | NaOH | Al﹣3e﹣=Al3+ | 2H2O+2e﹣=2OH﹣+H2↑ |
B | 負極 | 稀鹽酸 | 2Al﹣6e﹣=2Al3+ | 6H++6e﹣=3H2↑ |
C | 正極 | 濃硝酸 | Cu﹣2e﹣﹣=Cu2+ | 2NO3﹣+4H+﹣4e﹣=2NO2↑+2H2O |
D | 負極 | 稀硝酸 | Cu﹣2e﹣=Cu2+ | 2NO3﹣+8H+=2NO↑+4H2O+6e﹣ |
其中正確的是________,由此推知,金屬作電極不僅與本身性質相關,而且與_________有關.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】科學家積極探索新技術對CO2進行綜合利用。
Ⅰ.CO2可用來合成低碳烯烴:2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) △H=akJ/mol
CH2=CH2(g)+4H2O(g) △H=akJ/mol
請回答:
(1)已知:H2和CH2=CH的燃燒熱分別是285.8kJ/mol和1411.0kJ/mol,且H2O(g)![]() H2O((1)△H=-44.0kJ/mol,則a=________kJ/mol。
H2O((1)△H=-44.0kJ/mol,則a=________kJ/mol。
(2)上述由CO2合成CH2=CH2的反應在________下自發進行(填“高溫”或“低溫”)。
(3)在體積為1L的恒容密閉容器中,充入3molH2和1molCO2,測得溫度對CO2的平衡轉化率和催化劑催化效率的影響如圖1所示。下列說法正確的是________。
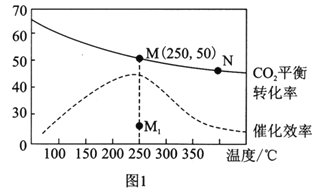
A.平衡常數大小:KMN
B.其他條件不變,若不使用催化劑,則250℃時CO2的平衡轉化率可能位于點M1
C.圖1中M點時,乙烯的體積分數為7.7%
D.當壓強或n(H2)/n(CO2)不變時均可證明化學反應已達到平衡狀態
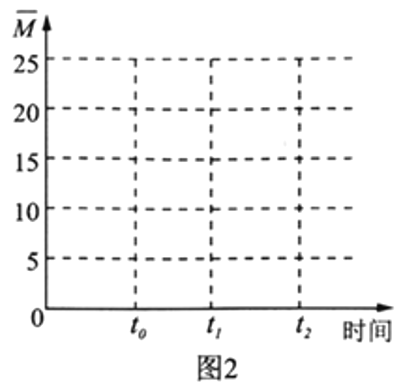
(4)保持溫度不變,在體積為V L的恒容容器中以n(H2)∶n(CO2)=3∶1的投料比加入反應物,t0時達到化學平衡。請在圖2中作出容器內混合氣體的平均相對分子質量![]() 隨時間變化的圖象。___________
隨時間變化的圖象。___________
Ⅱ.利用“Na-CO2”電池將CO2變廢為寶。我國科研人員研制出的可充電“Na-CO2”電池,以鈉箔和多壁碳納米管(MWCNT)為電極材料,總反應為4Na+3CO2![]() 2Na2CO3+C。放電時該電池“吸入”CO2,其工作原理如圖3所示:
2Na2CO3+C。放電時該電池“吸入”CO2,其工作原理如圖3所示:
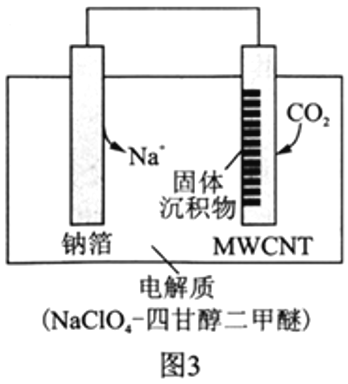
(5)放電時,正極的電極反應式為__________________。
(6)若生成的Na2CO3和C全部沉積在正極表面,當轉移0.2mole-時,正極增加的質量為_______g。
(7)選用高氯酸鈉四甘醇二甲醚做電解液的優點是_____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學實驗室需要0.2mol/L NaOH溶液500mL和0.5mol/L硫酸溶液450mL.根據這兩種溶液的配制情況回答下列問題:
(1)如圖所示的儀器中配制溶液肯定不需要的是________(填序號),配制上述溶液還需用到的玻璃儀器是________(填儀器名稱).
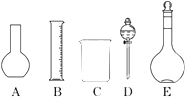
(2)容量瓶是配制溶液的主要儀器,容量瓶上標有以下六項中的________(填寫序號).
①溫度 ②濃度 ③容量 ④壓強 ⑤酸式或堿式 ⑥刻度線
(3)配制時,其正確的操作順序是(用字母表示,每個字母只能用一次)________.
A.用30mL水洗滌燒杯2~3次,洗滌液均注入容量瓶
B.準確稱取計算量的氫氧化鈉固體于燒杯中,再加入少量水(約50mL),用玻璃棒慢慢攪動,使其充分溶解,冷卻到室溫
C.將容量瓶蓋緊,搖勻
D.將溶解的氫氧化鈉溶液沿玻璃棒注入容量瓶中
E.改用膠頭滴管加水,使溶液凹液面恰好與刻度相切
F.繼續往容量瓶內小心加水,直到液面接近刻度2~3cm處
(4)根據計算,配制0.2mol/L NaOH溶液500mL需 NaOH固體的質量為:________g.
(5)配制過程中需先在燒杯中將濃硫酸進行稀釋,稀釋時操作方法是:________.
(6)將所配制的稀H2SO4進行測定,發現實際濃度小于0.5mol/L.請你分析下列哪些操作會引起所配濃度偏小(填寫字母)_______ .
A.用量筒量取濃硫酸時,仰視量筒的刻度
B.容量瓶未干燥即用來配制溶液
C.濃硫酸在燒杯中稀釋后,未冷卻就立即轉移到容量瓶中,并進行定容
D.往容量瓶轉移時,有少量液體濺出
E.在容量瓶中定容時俯視容量瓶刻度線
F.燒杯未進行洗滌
G.定容后塞上瓶塞反復搖勻,靜置后,液面不到刻度線,再加水至刻度線.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(15分)二氧化硫是重要的工業原料,探究其制備方法和性質具有非常重要的意義。
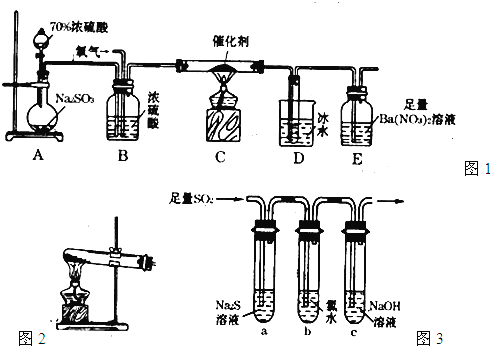
(1)實驗室用圖1裝置測定SO2催化氧化為SO3的轉化率。(已知SO3熔點為16.8℃,假設氣體進入裝置時分別被完全吸收,且忽略空氣中CO2的影響。)
①簡述使用分液漏斗向圓底燒瓶中滴加濃硫酸的操作: 。
②實驗過程中,需要通入氧氣。試寫出一個用如圖2所示裝置制取氧氣的化學方程式: 。
③當停止通入SO2熄滅酒精燈后,需要繼續通一段時間的氧氣,其目的是: 。
④實驗結束后,若裝置D增加的質量為mg,裝置E中產生白色沉淀的質量為ng,則此
條件下二氧化硫的轉化率是 (用含字母的代數式表示,不用化簡)。
(2)某學習小組設計用如圖3裝置驗證二氧化硫的化學性質。
①能說明二氧化硫具有氧化性的實驗現象為: 。
②為驗證二氧化硫的還原性,充分反應后,取試管b中的溶液分三份,分別進行如下實驗。
方案I:向第一份溶液中加入AgNO3溶液,有白色沉
淀生成。
方案II:向第二份溶液中加入品紅溶液,紅色褪去。
方案III:向第三份溶液中加入BaC12溶液,產生白色沉淀
上述方案中合理的是 (填“I”、“II”、或“III”);
試管b發生反應的離子方程式: 。
③當通入二氧化硫至試管c中溶液顯中性時,該溶液中
c(Na+)= (用含硫微粒濃度的代數式表示)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com