
下圖為制取乙酸乙酯的實驗裝置圖。回答下列問題: 
(1)揭示實驗原理
①乙酸與乙醇在催化劑存在的條件下加熱可以發生反應生成乙酸乙酯。請用氧同位素示蹤法寫出乙酸與乙醇發生酯化反應的化學方程式______________________。
②能否用氫同位素示蹤法揭示酯化反應原理? _______(選填“能”或“不能”),原因是___________________。
(2)反應溫度確定:
合成乙酸乙酯的反應為放熱反應。實驗表明,反應溫度應控制在85℃左右為宜。回答:
實驗溫度不宜低于85℃左右的原因是__________________________________________;
實驗溫度不宜高于85℃左右的原因是__________________________________________;
(3)實驗裝置的比較:
利用如圖裝置制備乙酸乙酯,這種裝置與教材裝置相比較突出的優點是__________________________。
(4)酯層厚度的標示:
為更好地測定酯層厚度,可預先向飽和Na2CO3溶液中滴加1滴____試液,現象是____________________________。
(1)①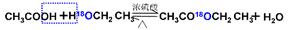 (2分)
(2分)
②否。醇和羧酸都失H,所以H換成D無法指示何種物質脫羥基。(各1分,共2分)
(2)反應速率低,達不到催化劑活性溫度;溫度過高利于平衡逆向移動,酯產率降低。(各2分,共4分)
(3)用分水器能夠在反應進行時很容易的把水分離出來,從而使平衡正向移動,提高乙酸乙酯的產率。(合理即給分 2分)
(4)酚酞。碳酸鈉層呈紅色,上層的酯層呈無色。(各1分,共2分)
解析試題分析:
(1)酯化反應中羧酸提供羥基,醇應該氫原子,所以反應的機理可以表示為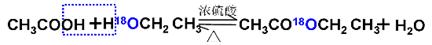 。
。
(2)由于醇和羧酸都失H,所以H換成D無法指示何種物質脫羥基,因此不能用氫同位素示蹤法揭示酯化反應原理。
溫度低,反應速率低,且達不到催化劑活性溫度,所以溫度不能低于85℃;正反應是放熱反應,溫度過高利于平衡逆向移動,酯產率降低,所以也不能高于85℃。
(3)根據裝置圖的結構特點可判斷,用分水器能夠在反應進行時很容易的把水分離出來,從而降低生成物濃度。使平衡正向移動,提高乙酸乙酯的產率。
(4)由于碳酸鈉溶液顯堿性,能使酚酞試液顯紅色,所以應該滴入酚酞試液,實驗現象是碳酸鈉層呈紅色,上層的酯層呈無色。
考點:考查酯化反應原理的探究、外界條件對反應速率和平衡對影響以及實驗評價


 課程達標測試卷闖關100分系列答案
課程達標測試卷闖關100分系列答案 新卷王期末沖刺100分系列答案
新卷王期末沖刺100分系列答案 全能闖關100分系列答案
全能闖關100分系列答案科目:高中化學 來源: 題型:計算題
已知反應:CO(g)+H2O(g) H2(g)+CO2(g)
H2(g)+CO2(g)
在427°C時的平衡常數是9.4.如果反應開始時,一氧化碳和水蒸氣的濃度都是0.01mol·L-1,計算一氧化碳在此反應條件下的轉化率。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
(16分)(2012?廣東)碘在科研與生活中有重要作用,某興趣小組用0.50mol?L﹣1KI、0.2%淀粉溶液、0.20mol?L﹣1K2S2O8、0.10mol?L﹣1Na2S2O3等試劑,探究反應條件對化學反應速率的影響.
已知:S2O82﹣+2I﹣=2SO42﹣+I2(慢) I2+2S2O32﹣=2I﹣+S4O62﹣ (快)
(1)向KI、Na2S2O3與淀粉的混合溶液中加入一定量的K2S2O8溶液,當溶液中的 耗盡后,溶液顏色將由無色變為藍色,為確保能觀察到藍色,S2O32﹣與S2O82﹣初始的物質的量需滿足的關系為:n(S2O32﹣):n(S2O82﹣) .
(2)為探究反應物濃度對化學反應速率的影響,設計的實驗方案如下表:
| 實驗 序號 | 體積V/ml | | |||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
某學生為了探究鋅與鹽酸反應過程中的速率變化,他在100mL稀鹽酸中加入足量的鋅粉,用排水集氣法收集反應放出的氫氣(標況),實驗記錄如下(累計值):
| 時間(min) | 1 | 2 | 3 | 4 | 5 |
| 氫氣體積(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
現甲、乙兩化學小組安裝兩套如下相同裝置,用以探究影響H2O2分解速率的因素。
(1)儀器a的名稱______;檢查裝置氣密性的操作為______。
(2)MnO2催化下H2O2分解的化學方程式是______。
(3)甲小組有如下實驗設計方案,請幫助完成(所有空均需填滿)。
⑷甲、乙兩小組得出如圖數據。
①由甲組實驗II得出的數據可知:濃度越大,H2O2分解速率______;
②由乙組研究的酸、堿對H2O2分解影響因素的 數據分析:相同條件下,Na2O2和K2O2溶于水放出氣體速率較快的是______;乙組提出可以用BaO2固體與H2SO4溶液反應制H2O2,其化學反應方程式為______;支持這一方案的理由是____________。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
已知鋅與稀硫酸反應為放熱反應,某學生為了探究其反應過程中的速率變化,用排水集氣法收集反應放出的氫氣,實驗記錄如下:
| 時間(min) | 1 | 2 | 3 | 4 | 5 |
| 氫氣體積(mL) | 30 | 120 | 280 | 350 | 370 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
(1)已知t ℃時AgCl的Ksp=2×10-10;(2)在t ℃時,Ag2CrO4在水中的沉淀溶解平衡曲線如圖所示。下列說法正確的是( )。
| A.在t ℃時,Ag2CrO4的Ksp為1×10-9 |
| B.在飽和Ag2CrO4溶液中加入K2CrO4可使溶液由Y點到X點 |
| C.在t℃時,以0.01 mol/L AgNO3溶液滴定20 mL0.01 mol/LKCl和0.01 mol/L的K2CrO4的混和溶液,Cl-先沉淀 |
| D.在t ℃時,AgCl的溶解度大于Ag2CrO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
已知某溶液中存OHˉ、H+、NH4+和C1ˉ四種離子,其濃度大小有如下關系:( )
①c(C1ˉ)>c(NH4+)>c(H+)>c(OH-)
②c(C1ˉ)>c(H+)>c(NH4+)>c(OH-)
③c(C1ˉ)=c(NH4+)且c(OHˉ)=c(H+)
④c(OHˉ)>c(H+)>c(C1ˉ)>c(NH4+)
⑤c(H+)>c(OH-)>c(C1-)>c(NH4+)
其中可能的是
| A.①④ | B.③⑤ | C.①②③ | D.④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列事實中,能說明HNO2是弱電解質的是
| A.用HNO2溶液做導電性實驗,燈泡較暗 |
| B.HNO2是共價化合物 |
| C.HNO2溶液不與NaCl反應 |
| D.室溫下,0.1mol·L-1 HNO2溶液的pH為2.15 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com