尿素(H
2NCONH
2)是一種非常重要的高氮化肥.在工農業生產中有著非常重要的地位.工業上合成尿素的反應如下:
2NH
3(g)+CO
2(g)?H
2O(g)+H
2NCONH(g)△H=-103.7kJ.mol
(1)在溫度70~95℃時,工業尾氣中的NO、NO
2可以尿素溶液吸收,將其轉化為N
2①尿素與NO、NO
2三者等物質的量反應,化學方程式為
.
②已知:N
2(g)+O
2(g)═2NO(g)△H=180.6kJ?mol
-1N
2(g)+3H
2(g)═2NH
3(g)△H=-92.4kJ?mol
-12H
2(g)+O
2(g)═2H
2O(g)△H=483.6kJ?mol
-1則4NO(g)+4NH
3(g)+O
2(g)═4N
2(g)+6H
2O(g)△H=
.
(2)某實驗小組模擬工業上合成尿素的條件.在恒定溫度下,將氨氣和二氧化碳按2:1的物質的量之比充入一體積為10L,的密閉容器中經20miri達到平衡,各物質濃度的變化曲線如圖所示.
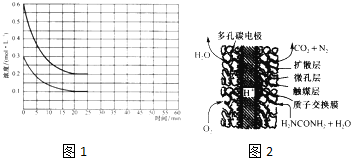
①在上述條件下,從反應開始至20min時.二氧化碳的平均反應速率為
.
②該反應的平衡常數K=
;若升高體系的溫度,容器中NH
3的體積分數將
(填“增加”、“減小”或“不變”).
③若保持平衡的溫度和壓強不變,再向容器中充入3mol的氨氣,則此時v
正
v
逆(填“>”“=”或“<”),判斷理由
.
(3)尿素燃料電池結構如圖所示.其工作時負極電極反應式可表示為
.



