
【題目】通過學習,同學們對宏觀辨識與微觀探析,變化觀念與平衡思想等學科素養有了進一步的認識和理解。請根據所學知識回答下列問題
(1)FeCl3溶液呈酸性原因是__________________(用離子方程式表示);若把FeCl3溶液蒸干,灼燒,最后得到固體產物是 ____________。
(2)將1L 0.2 mol·L-1HA溶液與1L 0.1 mol·L-1NaOH溶液等體積混合(混合后溶液體積變化忽略不計),測得混合溶液中c(Na+)> c(A-),則混合溶液中c(HA)+c(A-)_____0.1 mol·L-1(填“>”、“<”或“=”)。
(3)濃度均為0.1 mol/L的四種溶液①氯化銨溶液、②碳酸氫銨溶液、③氨水、④硫酸氫銨中,NH4+濃度由大到小的順序為________________________。(填序號)
(4)已知:常溫下,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4×10-38。
①常溫下,某酸性MgCl2溶液中含有少量的FeCl3 ,為了得到純凈的MgCl2·2H2O晶體,應加入________(填化學式),調節溶液的pH=4,使溶液中的Fe3+轉化為Fe(OH)3沉淀,此時溶液中的c(Fe3+)=________mol·L-1。
②常溫下,若將0.01 mol·L-1 MgCl2溶液與________ mol·L-1 NaOH溶液等體積混合時有沉淀生成。
【答案】Fe 3++3H2O![]() Fe(OH)3+3H+ Fe2O3 = ④>①>②>③ MgO[或Mg(OH)2、MgCO3]等 4×10-8 1.2×10-4
Fe(OH)3+3H+ Fe2O3 = ④>①>②>③ MgO[或Mg(OH)2、MgCO3]等 4×10-8 1.2×10-4
【解析】
(1)FeCl3溶液呈酸性的原因是Fe3+發生水解生成Fe(OH)3和H+;若把FeCl3溶液蒸干、灼燒,水解生成的HCl揮發,Fe(OH)3分解,由此可得最后得到固體產物的成分。
(2)將1L 0.2 mol·L-1HA溶液與1L 0.1 mol·L-1NaOH溶液等體積混合,發生反應HA+NaOH=NaA+H2O,此時溶液中c(HA)=c(A-),測得混合溶液中c(Na+)> c(A-),則表明溶液中以A-水解為主,依據物料守恒,可得出c(HA)+c(A-)與0.1 mol·L-1的關系。
(3)濃度均為0.1 mol/L的四種溶液
①氯化銨溶液中,NH4Cl=NH4++Cl-,NH![]() +H2O
+H2O![]() NH3·H2O + H+;
NH3·H2O + H+;
②碳酸氫銨溶液中,NH4HCO3=NH4++HCO3-,NH![]() + HCO3-+H2O
+ HCO3-+H2O![]() NH3·H2O + H2CO3;
NH3·H2O + H2CO3;
③氨水中,NH3·H2O![]() NH
NH![]() + OH-;
+ OH-;
④硫酸氫銨中,NH4HSO4=NH4++H++SO42-,NH![]() +H2O
+H2O![]() NH3·H2O + H+;
NH3·H2O + H+;
以①中氯化銨溶液為參照,依據NH4+所在環境對NH4+的促進或抑制,確定濃度由大到小的順序。
(4)①常溫下,某酸性MgCl2溶液中含有少量的FeCl3,為了得到純凈的MgCl2·2H2O晶體,應加入鎂的氧化物、氫氧化物、碳酸鹽等,調節溶液的pH=4,此時c(OH-)=10-10mol/L,代入Ksp[Fe(OH)3]=4×10-38,求溶液中的c(Fe3+)。
②常溫下,利用Ksp[Mg(OH)2]=1.8×10-11,求0.01 mol·L-1 MgCl2溶液有沉淀生成時,所需NaOH溶液的濃度。
(1)FeCl3溶液呈酸性的原因是Fe3+發生水解生成Fe(OH)3和H+,反應的離子方程式為Fe 3++3H2O![]() Fe(OH)3+3H+;若把FeCl3溶液蒸干、灼燒,水解生成的HCl揮發,Fe(OH)3分解,最后得到固體產物為Fe2O3。答案為:Fe 3++3H2O
Fe(OH)3+3H+;若把FeCl3溶液蒸干、灼燒,水解生成的HCl揮發,Fe(OH)3分解,最后得到固體產物為Fe2O3。答案為:Fe 3++3H2O![]() Fe(OH)3+3H+;Fe2O3;
Fe(OH)3+3H+;Fe2O3;
(2)將1L 0.2 mol·L-1HA溶液與1L 0.1 mol·L-1NaOH溶液等體積混合,發生反應HA+NaOH=NaA+H2O,此時溶液中c(HA)=c(A-)=0.05 mol·L-1,測得混合溶液中c(Na+)> c(A-),則表明溶液中以A-水解為主,依據物料守恒,可得出c(HA)+c(A-)= 2×0.05 mol·L-1=0.1 mol·L-1。答案為:=;
(3)①氯化銨溶液中,NH4Cl=NH4++Cl-,NH![]() +H2O
+H2O![]() NH3·H2O + H+;
NH3·H2O + H+;
②碳酸氫銨溶液中,NH4HCO3=NH4++HCO3-,NH![]() + HCO3-+H2O
+ HCO3-+H2O![]() NH3·H2O + H2CO3,由于HCO3-水解反應的促進,c(NH
NH3·H2O + H2CO3,由于HCO3-水解反應的促進,c(NH![]() )比①中小;
)比①中小;
③氨水中,NH3·H2O![]() NH
NH![]() + OH-,由于電離程度較小,所以溶液中c(NH
+ OH-,由于電離程度較小,所以溶液中c(NH![]() )比②中小;
)比②中小;
④硫酸氫銨中,NH4HSO4=NH4++H++SO42-,NH![]() +H2O
+H2O![]() NH3·H2O + H+,由于H+的抑制作用,溶液中c(NH
NH3·H2O + H+,由于H+的抑制作用,溶液中c(NH![]() )比①中大;
)比①中大;
依據上述分析,c(NH![]() )由大到小的順序為④>①>②>③。答案為:④>①>②>③;
)由大到小的順序為④>①>②>③。答案為:④>①>②>③;
(4)①常溫下,某酸性MgCl2溶液中含有少量的FeCl3,為了得到純凈的MgCl2·2H2O晶體,應加入MgO[或Mg(OH)2、MgCO3]等;溶液的pH=4,此時c(OH-)=10-10 mol·L-1,代入Ksp[Fe(OH)3]=4×10-38,求得溶液中的c(Fe3+)=![]() =4×10-8 mol·L-1。答案為:MgO[或Mg(OH)2、MgCO3]等;4×10-8;
=4×10-8 mol·L-1。答案為:MgO[或Mg(OH)2、MgCO3]等;4×10-8;
②常溫下,利用Ksp[Mg(OH)2]=1.8×10-11,要使0.01 mol·L-1 MgCl2溶液有沉淀生成,設加入等體積NaOH溶液的濃度為x,則![]() ,x=1.2×10-4 mol·L-1。答案為:1.2×10-4。
,x=1.2×10-4 mol·L-1。答案為:1.2×10-4。


科目:高中化學 來源: 題型:
【題目】取軟錳礦石(主要成分為MnO2)116 g跟足量濃鹽酸發生如下反應(雜質不參與反應)MnO2+4HCl(濃)![]() MnCl2+Cl2↑+2H2O,制得22.4 L Cl2(標準狀況),下列有關說法中不正確的是
MnCl2+Cl2↑+2H2O,制得22.4 L Cl2(標準狀況),下列有關說法中不正確的是
A.這種軟錳礦石中MnO2的質量分數為75%
B.被氧化的HCl的物質的量為4 mol
C.參加反應的HCl的質量為146 g
D.被還原的MnO2的物質的量為1 mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖流程中a、b、c、d、e、f是六種有機物,其中a是烴類,其余是烴的衍生物。下列有關說法正確的是( )

A.若a的相對分子質量是42,則d是乙醛
B.若d的相對分子質量是44,則a是乙炔
C.若a為苯乙烯(C6H5—CH=CH2),則f的分子式是C16H32O2
D.若a為單烯烴,則d與f的最簡式一定相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關裝置圖的敘述中正確的是( )
A.裝置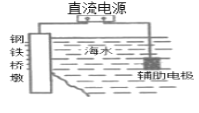 中橋墩應與電源的負極相連能被保護,該方法叫做外加電流的陰極保護法
中橋墩應與電源的負極相連能被保護,該方法叫做外加電流的陰極保護法
B.裝置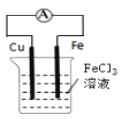 的總反應式:Cu+2Fe3+=Cu2++2Fe2+
的總反應式:Cu+2Fe3+=Cu2++2Fe2+
C.裝置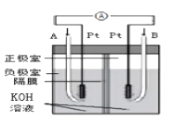 為氫氧燃料電池的工作原理,A中通入的氣體是氧氣
為氫氧燃料電池的工作原理,A中通入的氣體是氧氣
D.裝置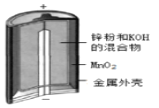 為堿性鋅錳干電池,其負極的電極反應式為:Zn-2e-=Zn2+
為堿性鋅錳干電池,其負極的電極反應式為:Zn-2e-=Zn2+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1mL濃度均為0.10mol/L的XOH和X2CO3溶液分別加水稀釋(溶液體積為V),溶液pH隨lgV的變化情況如圖所示,則下列說法正確的是( )
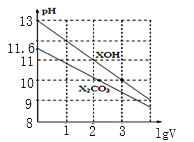
A.XOH是弱堿
B.pH=10的溶液中c(X+):XOH大于X2CO3
C.CO32-的水解常數Kh1約為1.0×10-3.8
D.當lgV=2時,升高X2CO3溶液溫度,溶液堿性增強且![]() 減小
減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用下列實驗裝置進行相應實驗,能達到實驗目的是( )
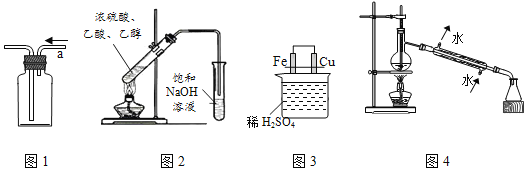
A. 用圖1從a口進氣可收集乙烯 B. 用圖2制取并收集乙酸乙酯
C. 用圖3比較Fe、Cu的金屬活動性 D. 用圖4進行石油的蒸餾實驗
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列與有機化合物相關的說法正確的是![]()
![]()
A.糖類、油脂、蛋白質都能水解,但水解產物不同
B.四苯基乙烯![]()
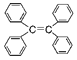
![]() 中所有碳原子一定處于同一平面
中所有碳原子一定處于同一平面
C.![]() 在一定條件下與足量H2反應消耗4mol H2
在一定條件下與足量H2反應消耗4mol H2
D.分子式為C7H8的芳香烴與H2完全加成所得產物的一氯代物有5種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將符合反應類型的反應的序號填在下列分類方法后的橫線上
A.4Fe3O4+O2![]() 6Fe2O3
6Fe2O3
B.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
C.Zn+H2SO4=ZnSO4+H2↑
D.CaCO3+2HCl=CaCl2+H2O +CO2↑
E.CH4+2O2![]() CO2+2H2O
CO2+2H2O
F. 3O2![]() 2O3
2O3
G.CuO+H2![]() Cu+H2O
Cu+H2O
H.H2SO4+2NaOH=Na2SO4+2H2O
①屬于化合反應的是____(填字母,下同)
②屬于分解反應的是____;
③屬于復分解反應的是____;
④屬于置換反應的是____;
⑤既不屬于四種基本反應類型又不屬于氧化還原反應的是____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)在粗制CuSO4·5H2O晶體中常含有雜質Fe2+。
①在提純時為了除去Fe2+,常加入合適的氧化劑,使Fe2+轉化為Fe3+,下列物質可作氧化劑的是__(填字母)。
A.KMnO4 B.H2O2 C.氯水 D.HNO3
②然后再加入適當物質調整溶液pH至4,使Fe3+轉化為Fe(OH)3,調整溶液pH可選用___(填字母)。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(2)甲同學懷疑調整溶液pH至4是否能達到除去Fe3+而不損失Cu2+的目的,乙同學認為可以通過計算確定,他查閱有關資料得到如下數據,常溫下Fe(OH)3的溶度積Ksp=1.0×10-38,Cu(OH)2的溶度積Ksp=3.0×10-20,通常殘留在溶液中的離子濃度小于1.0×10-5mol·L-1時就被認定為沉淀完全,設溶液中CuSO4的濃度為3.0mol·L-1,則Cu(OH)2開始沉淀時溶液的pH為__,Fe3+完全沉淀[即c(Fe3+)≤1.0×10-5mol·L-1]時溶液的pH為__,通過計算確定上述方案__(填“可行”或“不可行”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com