
【題目】明礬石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,還含有少量Fe2O3雜質。利用明礬石制備氫氧化鋁的流程如下:
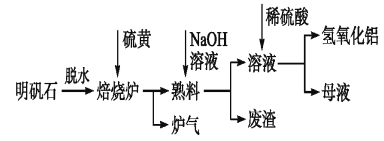
(1)焙燒爐中發生反應的化學方程式為2Al2(SO4)3+3S![]() 2Al2O3+9SO2,該反應的氧化劑是___________;若生成1 mol Al2O3,則轉移的電子數為__________________。
2Al2O3+9SO2,該反應的氧化劑是___________;若生成1 mol Al2O3,則轉移的電子數為__________________。
(2)熟料溶解時,反應的離子方程式為________________。
(3)母液中溶質主要成分為__________。(填化學式)
(4)檢驗廢渣中主要成分的方法:
①操作__________________________,
②現象__________________________,
③結論__________________________。
【答案】(1)Al2(SO4)3;3.612×1024(寫6NA也給分)
(2)Al2O3+2OH-=2AlO2-+H2O(3)K2SO4、Na2SO4
(4)①操作:取少量廢渣于試管,加入適量稀硫酸(或稀酸),溶解后滴加KSCN溶液②現象:溶液變紅色③結論:廢渣中含有Fe2O3
【解析】
試題分析:(1)根據方程式可知,反應中硫元素化合價由Al2(SO4)3中+6價降低為SO2中+4價,得到2個電子,發生還原反應,所以Al2(SO4)3是氧化劑。反應中硫元素化合價由0價升高為SO2中+4價,硫單質為還原劑,生成1molAl2O3需要硫的物質的量為1mol×![]() =1.5mol,所以轉移電子的物質的量為1.5mol×4=6mol,轉移電子數目為6mol×6.02×1023mol-1=3.612×1024。
=1.5mol,所以轉移電子的物質的量為1.5mol×4=6mol,轉移電子數目為6mol×6.02×1023mol-1=3.612×1024。
(2)氧化鋁是兩性氧化物,能溶于氫氧化鈉溶液中,所以由工藝流程可知,熟料溶解為氧化鋁與氫氧化鈉溶液反應生成偏鋁酸鈉,反應離子方程式為Al2O3+3H2O+2OH-=2[Al(OH)4]-。
(3)由工藝流程可知,熟料溶解所得的溶液中含有K+、Na+、SO42-、[Al(OH)4]-、OH-等,加硫酸調pH值,[Al(OH)4]-轉化為Al(OH)3沉淀而析出,母液中離子主要有K+、Na+、SO42-,因此含有溶質為K2SO4、Na2SO4。
(4)由工藝流程可知,廢渣的主要成分為Fe2O3,可以通過檢驗鐵離子來檢驗氧化鐵。即取少量廢渣,加入適量鹽酸溶解,再滴加KSCN溶液,若溶液被紅色,說明廢渣中含有Fe2O3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】下列反應既是氧化還原反應,又是吸熱反應的是
A.灼熱的炭與CO2反應 B.鋁片與稀硫酸反應
C.Ba(OH)2·8H2O與NH4Cl的反應 D.甲烷在O2中的燃燒
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合成氨是人類科學技術上的一項重大突破,其反應原理為N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1。一種工業合成氨的簡式流程圖如下:
2NH3(g) ΔH=-92.4 kJ·mol-1。一種工業合成氨的簡式流程圖如下:
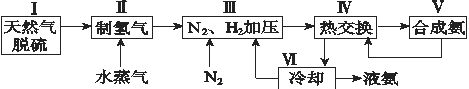
(1)天然氣中的H2S雜質常用氨水吸收,產物為NH4HS。一定條件下向NH4HS溶液中通入空氣,得到單質硫并使吸收液再生,寫出再生反應的化學方程式:_______________。
(2)步驟Ⅱ中制氫氣的原理如下:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
對于反應①,一定可以提高平衡體系中H2的百分含量,又能加快反應速率的措施是 __。
利用反應②,將CO進一步轉化,可提高H2的產量。若1 mol CO和H2的混合氣體(CO的體積分數為20%)與H2O反應,得到1.18 mol CO、CO2和H2的混合氣體,則CO的轉化率為____________。
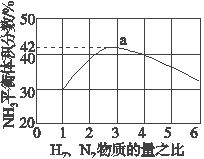
(3)如圖表示500 ℃、60.0 MPa條件下,原料氣投料比與平衡時NH3體積分數的關系。根據圖中a點數據計算N2的平衡體積分數:______________。
(4)上述流程圖中,使合成氨放出的能量得到充分利用的主要步驟是(填序號)_____________。簡述本流程中提高合成氨原料總轉化率的方法:_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲、乙兩個小組利用酸性KMnO4與H2C2O4溶液反應,設計實驗探究影響反應速率的因素(2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2+8H2O)
甲組:利用如圖裝置,通過測定單位時間內生成CO2氣體體積的大小來比較化學反應速率的大小.(實驗中所用KMnO4溶液均已加入H2SO4)
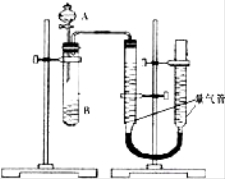
序號 | A溶液 | B溶液 |
① | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
② | 2ml 0.1mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
③ | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液和少量MnSO4 |
(1)該實驗的目的是探究________________對化學反應速率的影響.
(2)分液漏斗中A溶液應該_____________加入(填“一次性”或“逐滴滴加”)
(3)實驗結束后,讀數前為了使兩個量氣管的壓強相等,避免產生壓強差,影響測定結果,需要進行的操作是____________________.
乙組:通過測定KMnO4溶液褪色所需時間的多少來比較化學反應速率為了探究KMnO4與H2C2O4濃度對反應速率的影響,某同學在室溫下完成以下實驗
實驗編號 | 1 | 2 | 3 | 4 |
水/ml | 10 | 5 | 0 | X |
0.5mol/L H2C2O4/ml | 5 | 10 | 10 | 5 |
0.2mol/L KMnO4/ml | 5 | 5 | 10 | 10 |
時間/s | 40 | 20 | 10 | ﹣﹣﹣ |
(4)X=____________
A.5 B.10 C.15 D.20
4號實驗中始終沒有觀察到溶液褪色,你認為可能的原因是____________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫能源是一種重要的清潔能源。現有兩種可產生H2的化合物甲和乙。將 6.00 g 甲加熱至完全分解,只得到一種常見金屬單質和 6.72 L 的 H2(已折算成標準狀況)。甲與水反應也能放出H2,同時還產生一種白色沉淀物,該白色沉淀既可以溶于鹽酸,也可溶于 NaOH 溶液。化合物乙在催化劑存在下可分解得到H2 和另一種單質氣體丙,丙在標準狀況下的密度為1.25 g·L-1。請回答下列問題:
(1)甲是_______________;乙是______________。( 填化學式)
(2)甲與水反應的化學方程式是____________。
(3)氣體丙的分子式是____________。
(4)乙在加熱條件下可與 CuO 發生反應,生成紅色固體和氣體丙,寫出該反應的化學方程式________________。
(5)有人提出產物Cu中可能還混有Cu2O,請設計實驗方案驗證:__________________。
(已知:Cu2O+2H+=Cu+Cu2++H2O;Cu、Cu2O 均可以溶解在 HNO3 溶液中)
(6)甲與乙之間_____________ (填“可能”或“不可能”)發生反應產生H2,判斷理由是_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應中,N元素只表現還原性的是
A. NO2與H2O反應 B. NH3與O2反應
C. 濃HNO3與Cu反應 D. NH4Cl與Ca(OH)2反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關實驗操作的敘述不正確的是
A. 過濾操作中,導流的玻璃棒應緊貼在三層濾紙上
B. 用滴管向試管滴加液體時,滴管的尖嘴應伸入試管內
C. 制備氫氧化鐵膠體時,將氯化鐵飽和溶液滴入沸水中
D. 向容量瓶轉移液體時,導流用的玻璃棒可以接觸容量瓶內壁
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列依據熱化學方程式得出的結論不正確的是( )
A.由C(s,石墨)═C(s,金鋼石) △H>0可知,金剛石比石墨穩定
B.CO(g)燃燒熱是283.0kJmol﹣1,則2CO2(g)═2CO(g)+O2(g)△H=+566.0kJmol﹣1
C.CH4(g)+2O2(g)═CO2+2H2O(I)△H<0,該反應的化學能可以轉化為電能
D.已知C(s)+O2(g)═CO2(g)△H1,C(s)+![]() O2(g)═CO(g)△H2,則△H1<△H2
O2(g)═CO(g)△H2,則△H1<△H2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為探討反應X+Y![]() Z中反應速率與反應物濃度的關系,實驗測得X、Y的初始濃度(用c表示,mol/L)與生成物Z的濃度達到0.0042mol/L時所需的時間如右表所示.下列關于該反應反應速率的判斷正確的是( )
Z中反應速率與反應物濃度的關系,實驗測得X、Y的初始濃度(用c表示,mol/L)與生成物Z的濃度達到0.0042mol/L時所需的時間如右表所示.下列關于該反應反應速率的判斷正確的是( )
c(X) | c(Y) | 所需時間(秒) |
0.10 | 0.10 | 0.60s |
0.20 | 0.10 | 0.15s |
0.20 | 0.05 | 0.30s |
A.與c(X)成正比且與c(Y)成正比
B.與c(X)成正比且與c(Y)無關
C.與c2(X)成正比且與c(Y)成正比
D.與c2(X)成正比且與c(Y)成反比
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com