
【題目】某市售鹽酸試劑瓶標簽上的部分信息如下:
鹽酸
分子式:HCl
相對分子質量:36.5
密度約1.18 g·mL-1
HCl的質量分數:36.5%
(1)該鹽酸的物質的量濃度c(HCl)=__ mol·L-1。
(2)取該鹽酸50 mL加水稀釋到500 mL,則稀釋后溶液中(HCl)= ___mol·L-1。
(3)取稀釋后鹽酸溶液100mL,該溶液中所含的氯離子的個數為:N(Cl—)=___NA
(4)取稀釋后的適量鹽酸與足量的鋅粒作用,生成0.25 mol氫氣,在標準狀況下氣體的體積是___L。
【答案】11.8 1.18 0.118 5.6
【解析】
(1)依據c=![]() 計算鹽酸的物質的量濃度;
計算鹽酸的物質的量濃度;
(2)依據稀釋過程中溶質的物質的量不變計算稀釋后鹽酸濃度;
(3)依據n=cV和N=n NA計算;
(4)依據V=nVm計算。
(1)該鹽酸的物質的量濃度c=![]() =
=![]() =11.8mol/L,故答案為:11.8;
=11.8mol/L,故答案為:11.8;
(2)設稀釋后鹽酸濃度為c,則依據稀釋過程中溶質的物質的量不變得:11.8mol/L×50mL=500mL×c,解得c=1.18mol/L,故答案為:1.18;
(3)稀釋后100mL鹽酸中含有氯離子的物質的量為0.1L×1.18mol/L=0.118mol,數目為0.118 NA,故答案為:0.118;
(4)0.25mol氫氣在標準狀況下的體積是0.25mol×22.4L/mol=5.6L,故答案為:5.6。


科目:高中化學 來源: 題型:
【題目】明礬[KAl(SO4)2·12H2O]是一復鹽,在造紙等方面應用廣泛。某興趣小組采用10.0g廢易拉罐(含90%的Al,還含有少量的Fe、Mg等雜質)制備明礬的實驗方案如下:
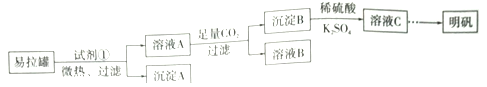
(1)試劑①應選用_____________(填代號)。
a.鹽酸 b.H2SO4溶液 c.氯化鈉溶液 d.NaOH溶液
(2)易拉罐溶解過程中主要反應的化學方程式為____________________。
(3)溶液B中溶質的主要成分為____________________ (填化學式)。
(4)從溶液C中得到明礬的實驗操作步驟為蒸發濃縮、__________(填操作名稱)、過濾、洗滌、干燥。如下圖所示,蒸發操作中的一處錯誤是_____________。

(5)該小組在實驗完成之后,得到118.5 g明礬,則明礬的回收率為_____________。(已知:明礬的摩爾質量為474g·mol-1)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA表示阿伏加德羅常數的值,下列說法正確的是( )
A.60g二氧化硅晶體中含有2NA個硅氧鍵
B.18g氨基(—ND2)中含有的電子數為9NA
C.80 °C時,lLpH =1的硫酸溶液中,含有的OH—數目為10—13NA
D.氯堿工業中,導線上流過NA個電子,則陽極放出氯氣11.2 L.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數,下列說法正確的是( )
A.含有相同銅原子數的Cu2S和CuO的質量相等B.2g氫氣所含質子數目為NA
C.lmol氨氣含有的原子數目為2NAD.22.4LCH4所含電子數目為l0NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】世界能源消費依靠化學技術,作為燃料的H2通常來自水煤氣。回答下列問題:
(1)己知:① C(s)+H2O(g)=CO(g)+H2(g)△H=akJ/mol②2C(s)+O2(g)=2CO(g) △H= -220 kJ/mol③2H2O(g)=2H2(g)+O2(g) △H=+480 kJ/mol,則 a=_____kJ/mol。
(2)某實驗小組在實驗室模擬反應C(s) +H2O (g)![]() CO (g) +H2 (g)能夠說明該反應達到平衡狀態的是____。
CO (g) +H2 (g)能夠說明該反應達到平衡狀態的是____。
a. v逆(H2O)=v正(CO) b.容器中物質的總質量不發生變化
c. n (H2O):n (H2)=1:1且不再改變 d.恒容容器中混合氣體密度不變
(3)一定溫度下,在2L盛有足量炭粉的恒容密閉容器中通入0.8molH2O發生反應①,6min時生成0.7 gH2則6 min內以CO表示的平均反應速率為 ______mol/Lmin-1 (保留2位有效數字)。
(4)燃料氣中CO需氧化為CO2與氫氣進行分離,使用CuO/CeO2做催化劑,并向其中加入不同的酸(HIO3 或H3PO4)后,CO的轉化率隨溫度的變化如圖所示。
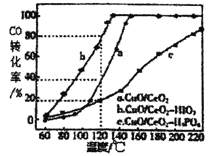
①加入H3PO4__________(填“促進”或,抑制”)CuO/CeO2的催化。
②CeO2可由草酸鋪[Ce2(C2O4)3]在空氣中灼燒制備,同時只產生一種氣體,寫出該反應的化學方程式_____。
③恒溫恒壓下,在溫度為120°C,催化劑為CuO/CeO2HIO3條件下反應,若起始時燃料氣流速為1800mLmin-1,其中CO的體積分數為0.68%,則反應0.5h后剩余氣體中CO的體積為__mL。
(5)有人將合成氨反應設計成原電池,裝置如圖所示。
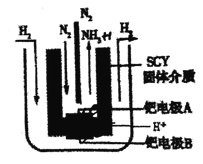
①正極反應式為 _______。
②己知該原電池的標準電動勢![]() ,25°C時反應的平衡常數K與
,25°C時反應的平衡常數K與![]() 之間的關系為
之間的關系為![]() (n為原電池反應轉移的電子數),則合成氨反應(N2 +3H2
(n為原電池反應轉移的電子數),則合成氨反應(N2 +3H2![]() 2NH3)的平衡常數K為 ______(用含a的代數式表示,不需要化簡)。
2NH3)的平衡常數K為 ______(用含a的代數式表示,不需要化簡)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物I是一種醫藥合成中間體,實驗室以芳香烴A為原料制備I的路線如下(部分反應條件已省略):
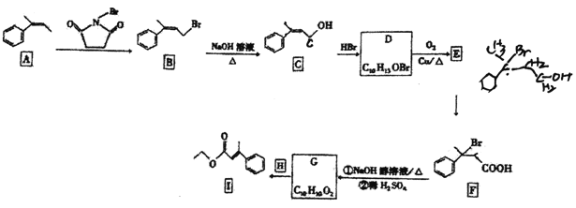
已知:RCH=CH2+HBr![]() RCH2CH2Br。回答下列問題:
RCH2CH2Br。回答下列問題:
(1)X的分子式為C8H8,且X與A互為同系物,則X的化學名稱是 ______。
(2)B生成C的反應類型是_____, B、C含有的相同的官能團名稱是 _____。
(3)碳原子上連有4個不同原子或基團時,該碳原子為手性碳原子。寫出D的結構簡式,并用星號![]() 標出其中的手性碳原子_____。
標出其中的手性碳原子_____。
(4)寫出D—E 的化學反應方程式:_________。
(5)G的結構簡式是 ______。
(6)Y與C是同分異構體,Y中含苯環,且苯環上有2個取代基,Y能發生銀鏡反應,其核磁共振氫譜中有5組峰,且峰面積之比為6:2:2:1:1,則Y的結構簡式為 _______。
(7)丙二酸(HOOCCH2COOH)主要用作醫藥合成中間體、電鍍拋光劑等。結合題目信息,設計以丙烯(CH3CH=CH2) 和![]() 為原料制備丙二酸的合成路線______(無機試劑任選)。
為原料制備丙二酸的合成路線______(無機試劑任選)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,![]() 和
和![]() 的電離常數分別為
的電離常數分別為![]() 和
和![]() 。將
。將![]() 和體積均相同的兩種酸溶液分別稀釋,其
和體積均相同的兩種酸溶液分別稀釋,其![]() 隨加水體積的變化如圖所示。下列敘述正確的是( )
隨加水體積的變化如圖所示。下列敘述正確的是( )

A. 曲線Ⅰ代表![]() 溶液
溶液
B. 溶液中水的電離程度:b點>c點
C. 從c點到d點,溶液中 保持不變(其中
保持不變(其中![]() 、
、![]() 分別代表相應的酸和酸根離子)
分別代表相應的酸和酸根離子)
D. 相同體積a點的兩溶液分別與![]() 恰好中和后,溶液中
恰好中和后,溶液中![]() 相同
相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種用于驅動檢驗管道焊縫設備爬行器的甲醇-燃料電池的工作原理示意如圖,下列有關該電池說法正確的是
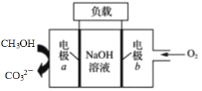
A.該電池工作時,每消耗22.4 L CH3OH轉移6 mol電子
B.電子由電極a經負載流向電極b,再經過氫氧化鈉溶液返回電極a,形成閉合回路
C.電池工作時,OH-向電極a移動,溶液的pH減小
D.電極b上發生的電極反應為O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】依據原電池原理,回答下列問題:

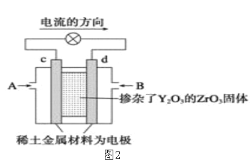
(1)圖1是依據氧化還原反應:Cu(s)+2Fe3+(aq)=Cu2+(aq)+2Fe2+(aq)設計的原電池裝置。
①電極X的材料是________(填化學名稱);電極Y的材料是__________(填化學名稱)。
②Y電極發生的電極反應式為:______________。
(2)圖2是使用固體電解質的燃料電池,裝置中,以稀土金屬材料作惰性電極,在兩極上分別通入CH4和空氣,其中固體電解質是摻雜了Y2O3的ZrO2固體,它在高溫下能傳導正極生成的O2-離子(O2+4e―→2O2-)。
①c電極為______________極。(填“正”或“負”)
②d電極上的電極反應式為___________________________。
③如果消耗甲烷160g,假設化學能完全轉化為電能,則轉移電子的數目為______________(用NA表示),需要消耗標準狀況下氧氣的體積為_______L。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com