
【題目】把足量熟石灰放入蒸餾水中,一段時間后達到平衡:Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq),下列敘述正確的是( )
Ca2+(aq)+2OH-(aq),下列敘述正確的是( )
A. 向溶液中加入少量的NaOH固體,則其中的Ca(OH)2的固體增多
B. 向溶液中加入Na2CO3溶液,則其中的Ca(OH)2的固體增多
C. 恒溫下向溶液中加入CaO,溶液的pH升高
D. 給溶液加熱,溶液的pH升高
【答案】A
【解析】分析:A、加入少量的NaOH固體,平衡向逆反應方向移動;
B、加入Na2CO3溶液,平衡向正方向移動;
C、恒溫下向溶液中加入CaO,仍為飽和溶液,濃度不變;
D、Ca(OH)2的溶解度隨溫度的升高而降低。
詳解:A、加入少量的NaOH固體,OH-濃度增大,平衡向逆方向移動,則Ca(OH)2的固體增多,A正確。
B、加入Na2CO3溶液,發生Ca2++CO32-=CaCO3↓,平衡向正方向移動,則Ca(OH)2的固體減少,B錯誤;
C、恒溫下向溶液中加入CaO,發生CaO+H2O=Ca(OH)2,仍為飽和溶液,pH不變,但是由于水量減少,故溶解的碳酸鈣減小,C錯誤;
D、給溶液加熱,Ca(OH)2的溶解度降低,溶液pH減小,D錯誤;答案選A。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】一定條件下,對于可逆反應X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始濃度分別為c1、c2、c3(均不為零),達到平衡時,X、Y、Z的濃度分別為0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,則下列判斷正確的是( )
2Z(g),若X、Y、Z的起始濃度分別為c1、c2、c3(均不為零),達到平衡時,X、Y、Z的濃度分別為0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,則下列判斷正確的是( )
A. c1∶c2=3∶1 B. 平衡時,Y和Z的生成速率之比為2∶3
C. X、Y的轉化率不相等 D. c1的取值范圍為0<c1<0.14 mol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】通過化學啟蒙學習,同學們對組成萬物的基本物質有了進一步了解。
(1)現有H、C、N、O、K五種元素,請選用其中的元素寫出下列物質的化學式:
①天然氣的主要成分____;
②極易與血紅蛋白結合的有毒氣體____;
③能供給呼吸的氣體____;
④可作復合肥的硝酸鉀____。
(2)如圖是某隕石樣品中各種元素含量的比例圖。

①該隕石中含____種非金屬元素,其中含有量最多的是____元素。
②鈉離子的結構示意圖為 ,則X=____。
,則X=____。
③此隕石樣品中不可能含有的化合物是____。
A.CaCO3 B.K2SO4 C.Al2O3 D.SiO2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋁是一種應用廣泛的金屬。某興趣小組對金屬鋁展開了系列研究。
I.研究鋁的化學性質
(1)鋁在常溫下會與氧氣反應,表面形成一層致密的氧化膜,化學方程式為______。實驗前,需要對鋁的表面先進行______(填操作)處理。興趣小組同學將鋁處理好后剪成若干大小相同的小片,用于后續實驗。
(2)鋁和酸、堿、鹽溶液的反應
實驗 | 操作 | 現象 | 結論 |
一 | 將鋁片放入稀鹽酸中 | ,試管變燙 | 鋁能與鹽酸發生反應,反應放熱 |
二 | 將鋁片放入氫氧化鈉溶液中 | 鋁表面有氣泡產生試管變燙 | 鋁能與氫氧化鈉溶液反應,反應放熱 |
三 | 將鋁放入硫酸銅溶液中 | 鋁表面有紅色物質產生,溶液逐漸變成無色 | 金屬活動性:鋁 銅 |
實驗一的現象為_____。
實驗二查閱資料:鋁和氫氧化鈉、水反應生成偏鋁酸鈉(NaAlO2)和氫氣,反應的化學方程式為____。實驗三表明,鋁的金屬活動性____(填“大于“或”小于“)銅。
(3)小組同學將實驗一中的稀鹽酸換成等質量、氫離子濃度相同的稀硫酸,相同時間內發現鋁片表面產生的氣泡較少,反應較慢。對比上述兩組實驗產生猜想。猜想①:稀鹽酸中的氯離子對反應可能有促進作用。猜想②:____。為驗證猜想①是否合理,應在鋁和稀硫酸中加入____(填字母),觀察現象。
A.Na2SO4 B.Na2CO3 C.NaCl
II.測定某鋁樣品中金屬鋁的質量分數
(資料1)氫氧化鋁能與氫氧化鈉溶液反應,但不與氨水反應。
(資料2)AlCl3+3NaOH=Al(OH)3↓+3NaCl;AlCl3+3NH3H2O=Al(OH)3↓+3NH4Cl。
(4)小組同學稱取4.62g某金屬鋁樣品(樣品中雜質僅為氧化鋁),置于圖一燒瓶中,加入足量稀鹽酸至完全反應。將反應后的液體分成溶液1和溶液2兩等份,設計兩種實驗方案(如圖三),通過沉淀質量測定樣品中金屬鋁的質量分數。

①選擇正確的一種實驗方案,計算樣品中金屬鋁的質量分數(請寫出計算過程)。_____。
②小組同學組合圖一和圖二裝置測氫氣體積,燒瓶中反應停止即讀出量筒內水的體積,計算后發現金屬鋁的質量分數偏大,可能的原因是_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】C、S和Cl元素的單質及化合物在工業生產中的有效利用備受關注。請回答下列問題:
(1)已知:I.2SO2(g)+O2(g)+2H2O(1) ===2H2SO4(aq) △H1;
Ⅱ.Cl2(g)+H2O(1)![]() HCl(aq)+HClO(aq) △H2;
HCl(aq)+HClO(aq) △H2;
Ⅲ.2HClO(aq) ===2HCl(aq)+O2(g) △H3
SO2(g)+Cl2(g)+2H2 O(1)=2HCl(aq)+H2SO4 (aq) △H4=____________________(用含有△H1、△H2和△H3的代數式表示)。
(2)25℃時,H2SO3溶液中各含硫微粒的物質的量分數(δ)與溶液pH的變化關系如圖甲所示。
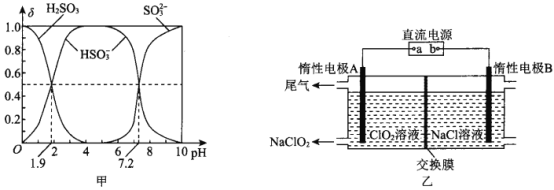
已知25℃時,NaHSO3的水溶液pH<7,用圖中的數據通過計算解釋原因 ____________________。
(3)NaClO2是一種綠色消毒劑和漂白劑,工業上采用電解法制備 NaClO2的原理如圖乙所示。
①交換膜應選用____________________(填“陽離子交換膜”或“陰離子交換膜”)
②陽極的電極反應式為________________________________________。
(4)一定溫度下,向2L恒容密閉容器中通入2molCO和1molSO2,發生反應2CO(g)+SO2(g) ![]() S(l)+2CO2(g) ΔH=-270kJ/mol,若反應進行到20min時達平衡,測得CO2的體積分數為0.5,則前20min的反應速率v(CO)= _________,該溫度下反應化學平衡常數K=____________(L·mol-1)
S(l)+2CO2(g) ΔH=-270kJ/mol,若反應進行到20min時達平衡,測得CO2的體積分數為0.5,則前20min的反應速率v(CO)= _________,該溫度下反應化學平衡常數K=____________(L·mol-1)

(5)在不同條件下,向2L恒容密閉容器中通入2molCO和1molSO2,反應體系總壓強隨時間的變化如圖(I)所示:
①圖(I)中三組實驗從反應開始至達到平衡時,v(CO)最大的為___________(填序號)
②與實驗a相比,c組改變的實驗條件可能是_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某城市主要空氣污染物為PM2.5、SO2、NOx。科學實驗小組為檢測空氣樣本成分,用蒸餾水處理制成待測液,設計實驗及所得實驗現象如下:
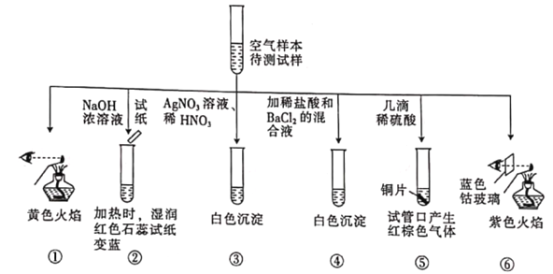
下列判斷不正確的是
A. 上述實驗中可用Ba(NO3)2代替BaCl2,以證明待測試樣中含SO42-
B. 由實驗②⑤可知待測試樣中含有NH4+和NO3-
C. 焰色反應表明待測試樣中含Na元素和K元素
D. 該城市的污染來源主要是燃煤和機動車尾氣排放
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學電池在通訊、交通及日常生活中有著廣泛的應用。
(1)Zn﹣MnO2干電池應用廣泛,其電解質溶液是ZnCl2﹣NH4Cl混合溶液。該電池的負極材料是______.電池工作時,電子流向______(填“正極”或“負極”)。
若ZnCl2﹣NH4Cl混合溶液中含有雜質Cu2+,會加速某電極的反應.其主要原因是_________________。
(2)鉛蓄電池是常用的化學電源,其電極材料分別是Pb和PbO2,電解液為硫酸。該電池總反應式為:
Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O。請根據上述情況判斷:
2PbSO4+2H2O。請根據上述情況判斷:
該蓄電池放電時,電解質溶液中陰離子移向_____________(填“正極”或“負極”);正極附近溶液的酸性_______(填“增強”、“減弱”或“不變”)放電時,負極的電極反應式為:________________。
(3)氫氧燃料電池具有啟動快、效率高等優點,其能量密度高于鉛蓄電池。若電解質為KOH溶液,則氫氧燃料電池的負極反應式為_________________________________。該電池工作時,外電路每流過2 mole-,消耗標況下氧氣____________L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以香蘭醛(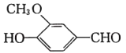 )為主要原料合成藥物利喘貝(V)的流程如下:
)為主要原料合成藥物利喘貝(V)的流程如下:
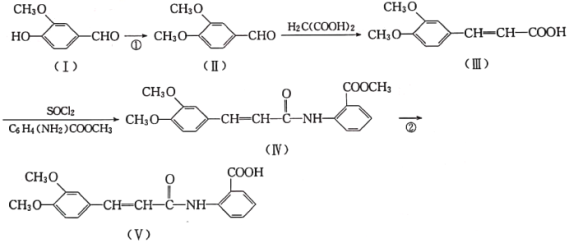
已知:![]() (酰胺鍵)在無肽鍵酶作用下的水解可忽略。
(酰胺鍵)在無肽鍵酶作用下的水解可忽略。
(1)H2C(COOH)2的化學名稱為___________。
(2)①的反應類型是___________。
(3)反應②所需試劑條件分別為___________、___________。
(4)利喘貝(V)的分子式為___________。
(5)Ⅲ中官能團的名稱是______________________。
(6)寫出與香蘭醛互為同分異構體的酯類化合物的結構簡式(且核磁共振氫譜為四組峰,峰面積之比為1:2:2:3):____________________________________________(寫出3種)。
(7)已知:![]() ,結合上述流程中的信息,設計以甲苯和甲醇為起始原料制備鄰氨基苯甲酸甲酯(
,結合上述流程中的信息,設計以甲苯和甲醇為起始原料制備鄰氨基苯甲酸甲酯(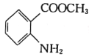 )的合成路線(其他無機試劑任選):__________________________________________________________________。
)的合成路線(其他無機試劑任選):__________________________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知一定條件下硝酸銨受熱分解的化學方程式為:5NH4NO3![]() 2HNO3+4N2↑+9H2O,下列說法正確的是( )
2HNO3+4N2↑+9H2O,下列說法正確的是( )
A. 分解反應都是氧化還原反應B. N2是還原產物,HNO3是氧化產物
C. 被氧化與被還原的氮原子數之比為3∶5D. 每生成4mol N2轉移15mol電子
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com