
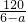 ,則XeO3的系數為______(用a表示).
,則XeO3的系數為______(用a表示).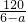 -36=
-36= ,故答案為:
,故答案為: ;
;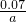 mol,故答案為:
mol,故答案為: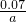 ;
;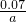 molXeFa與水反應生成0.005molXeO3,XeFa與XeO3的物質的量之比等于化學計量數之比,則:
molXeFa與水反應生成0.005molXeO3,XeFa與XeO3的物質的量之比等于化學計量數之比,則: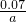 mol:0.005mol=
mol:0.005mol=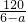 :
: ,解得a=3.5,故答案為:3.5;
,解得a=3.5,故答案為:3.5;

科目:高中化學 來源: 題型:
| 120 |
| 6-a |
| 36a-96 |
| 6-a |
| 36a-96 |
| 6-a |
| 0.07 |
| a |
| 0.07 |
| a |
查看答案和解析>>
科目:高中化學 來源: 題型:013
氙和氟按一定比例混合,在一定條件下直接反應:Xe+2F2=XeF4+218 KJ,這說明:①Xe的結構和穩定性是相對的;②Xe在一定條件下可顯正化合價;③XeF4是相對穩定的化合物;④加壓有利于XeF4的生成。以上結論正確的是( )
A.只有①②
B.只有①④
C.只有①②④
D.全部
查看答案和解析>>
科目:高中化學 來源:物理教研室 題型:013
A.只有①②
B.只有①④
C.只有①②④
D.全部
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com