
【題目】2014年12月科學家發現了迄今為止最輕的冰——“冰十六”,它是水的一種結晶形式,有著像籠子一樣、可以困住其他分子的結構。下列有關敘述中不正確的是
A.冰的密度比液態水小B.冰與干冰由不同分子構成
C.“冰十六”可以包合氣體分子D.液態水轉變成“冰十六”是化學變化
科目:高中化學 來源: 題型:
【題目】下列過程的能量變化符合下圖所示的是

A. 酸堿中和反應
B. CH4在O2中燃燒
C. NH4Cl晶體與Ba(OH)28H2O晶體混合攪拌
D. CaO溶于水生成Ca(OH)2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(8分)短周期元素Q、R、T、W在元素周期表中的位置如圖所示,其中,T所處的周期序數與主族序數相等。請回答下列問題:

(1)T的原子結構示意圖為________。
(2)元素的非金屬性(原子的得電子能力):Q________W(填“強于”或“弱于”)。
(3)W的單質與其最高價氧化物的水化物濃溶液共熱能發生反應,生成兩種物質,其中一種是氣體,反應的化學方程式為__________________________。
(4)原子序數比R多1的元素的一種氫化物能分解為它的另一種氫化物,此分解反應的化學方程式是__________________。
(5)R有多種氧化物,其中甲的相對分子質量最小。在一定條件下,2 L的甲氣體與0.5 L的氧氣相混合,若該混合氣體被足量的NaOH溶液完全吸收后沒有氣體殘留,所生成R的含氧酸鹽只有一種,則該含氧酸鹽的化學式是________________。
(6)在298K下,Q、T的單質各1 mol完全燃燒,分別放出熱量a kJ和b kJ。又知一定條件下,T的單質能將Q從它的最高價氧化物中置換出來,若此置換反應生成3 mol Q的單質,則該反應在298K下的ΔH=________(注:題中所涉單質均為最穩定單質)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某課外小組設計的實驗室制取并提純乙酸乙酯的方案如下所示
已知:①氯化鈣可與乙醇形成CaCl26C2H5OH;
②有關有機物的沸點如下表所示
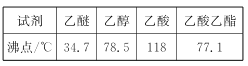
③2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
I.制備過程:裝置如圖所示,A中盛有濃硫酸,B中盛有9.5mL無水乙醇和6mL冰醋酸,D中盛有飽和碳酸鈉溶液。
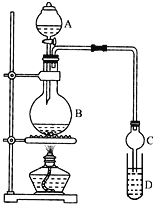
(1)實驗過程中滴加大約3mL濃硫酸,B的容積最合適的是_____(填字母代號)
A. 25 mL B 50 mL C. 250 mL D. 500 mL
(2)球形干燥管的主要作用是_______________。
(3)飽和碳酸鈉溶液的作用是______(填字母代號)。
A.消耗乙酸并溶解乙醇
B.碳酸鈉溶液呈堿性,有利于乙酸乙酯的水解
C.加速乙酸乙酯的生成,提高其產率
D.乙酸乙酯在飽和碳酸鈉溶液中的溶解度比在水中的更小,有利于分層析出
II.提純方法:
①將D中混合液進行分離。
②有機層用5mL飽和食鹽水洗滌,再用5mL飽和氯化鈣溶液洗滌,最后用水洗滌。有機層倒入一干燥的燒瓶中,選用合適的干燥劑干燥,得到粗產品。
③將粗產品蒸餾,收集77.1℃時的餾分,得到純凈、干燥的乙酸乙酯。
(4)第①步分離混合液時,選用的主要玻璃儀器的名稱是_____________。
(5)第②步中用飽和食鹽水洗去碳酸鈉后,再用飽和氯化鈣溶液洗滌,主要洗去粗產品中的______(填物質名稱)。再加入_______(此空從下列選項中選擇,四種物質均有吸水性)干燥
A.濃硫酸 B.堿石灰 C.無水硫酸鈉 D.生石灰
(6)加熱有利于提高乙酸乙酯的產率,但實驗發現溫度過高乙酸乙酯的產率反而降低,一個可能的原因是_____________________________________________。
(7)若實驗所用乙酸的質量為2.4g,乙醇的質量為2.1g,得到純凈的產品的質量為2.64g,則乙酸乙酯的產率是___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列事實,不能用勒夏特列原理解釋的是
A. 溴水中有如下平衡:Br2+H2OHBr+HBrO,加入AgNO3溶液后,溶液顏色變淺
B. 合成NH3反應,為提高NH3的產率,理論上應采取相對較低溫度的措施
C. 氯氣在水中的溶解度大于在飽和食鹽水中的溶解度
D. 對CO(g)+NO2(g)CO2(g)+NO(g)平衡體系增大壓強可使顏色變深
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合成氯是人類研究的重要課題,目前工業合成氨的原理為:N2(g) + 3H2(g) 2NH3(g) ΔH=-93.0kJ/mol
(1)某溫度下,在2 L密閉容器中發生上述反應,測得數據如下
時間/h 物質的量/mol | 0 | 1 | 2 | 3 | 4 |
N2 | 2.0 | 1.83 | 1.7 | 1.6 | 1.6 |
H2 | 6.0 | 5.49 | 5.1 | 4.8 | 4.8 |
NH3 | 0 | 0.34 | 0.6 | 0.8 | 0.8 |
①0~2 h內,v(N2)=____________。
②平衡時,H2的轉化率為____;該溫度下,反應2NH3(g)N2(g) + 3H2(g) 的平衡常數K=___(mol/L)2。
③若保持溫度和體積不變,起始投入的N2、H2、NH3的物質的量分別為a mol、b mol、c mol,達到平衡后,NH3的濃度與上表中相同的為_______(填選項字母)。
A.a=l、b=3、c=0 B.a=4、b=12、c=0
C.a=0、b=0、c=4 D.a=l、b=3、c=2
(2)另據報道,常溫、常壓下,N2在摻有少量氧化鐵的二氧化鈦催化劑表面能與水發生反應,生成NH3和O2。已知:H2的燃燒熱ΔH=-286.0kJ/mol,則用N2與水反應制NH3的熱化學方程式為________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】膠體和溶液的特征區別是( )
A. 膠體屬于介穩體系 B. 膠體粒子的大小在1nm~100nm之間
C. 膠體具有丁達爾效應 D. 膠體粒子不能透過濾紙
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2一氨-3—氯苯甲酸是白色晶體,其制備流程如下:
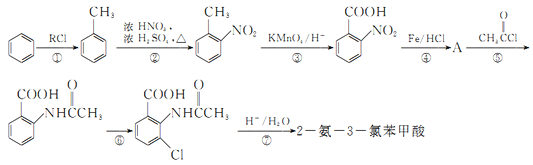
已知:
回答下列相關問題
(1)![]() 的名稱是__________,2-氨-3-氯苯甲酸中含N官能團的電子式為__________。
的名稱是__________,2-氨-3-氯苯甲酸中含N官能團的電子式為__________。
(2)反應①中R代表的是_____________,反應②的反應類型為_____________。
(3)如果反應③中KMnO4的還原產物為MnSO4,請寫出該反應的化學方程式_____________。
(4)A的結構簡式為_____________,⑥的反應條件為_____________。
(5)符合下列條件的同分異構體的結構簡式為_____________。
a.式量比![]() 大42的苯的同系物;
大42的苯的同系物;
b.與酸性KMnO4反應能生成二元羧酸
c.僅有3種等效氫
(6)事實證明上述流程的目標產物的產率很低;據此,研究人員提出將步驟⑥設計為以下三步,產率有了一定提高。
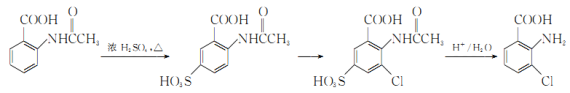
分析產率提高的原因是_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某人設計淀粉利用方案如下圖所示:其中A是乙烯能催熟水果,B是高分子化合物,D是有水果香味的物質。請回答以下問題:

(1)“C6H12O6”的名稱是________,工業上由石蠟制取A的方法稱作____。C中含有官能團名稱是____________;
(2)A→B反應類型為_________________;C→D反應類型為_________________;
(3)寫出下列轉化的化學方程式
①A→B:__________________;
②C→D:___________________________;
③CH3CH2OH→CH3CHO:_________________________。
(4)已知A能使酸性高錳酸鉀褪色,還原產物為Mn2+,寫出該氧化還原反應的離子方程式____________________________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com