
【題目】短周期元素W、X、Y、Z的原子序數依次增大,Y的原子半徑是短周期主族元素中最大的,元素W的最外層電子數是次外層的2.5倍,元素X的最外層電子數是電子層數的3倍,元素Z的單質,通常為黃綠色氣體,與Y的最高價氧化物的水化物反應的產物可作漂白劑和消毒劑。
(1)元素W、X、Y、Z的符號分別是______,______,______,______。
(2)實驗中制備Z單質的反應方程式為 ________________________。
(3)Z單質與X的氫化物發生反應的化學方程式為 __________________ 。若將干燥的有色布條放入Z的單質中,觀察到的現象是 ___________________,原因是__________。
(4)Z單質與Y的最高價氧化物的水化物反應的化學方程式是_______,該反應中2mol Z完全反應時轉移電子的數目_______ NA。
(5)實驗中制備W的氫化物的反應方程式為 _________________。
【答案】N O Na Cl ![]()
![]() 有色布條未褪色 干燥的氯氣沒有漂白性
有色布條未褪色 干燥的氯氣沒有漂白性 ![]() 2
2 ![]()
【解析】
(1)Y的原子半徑是短周期主族元素中最大的,Y為Na元素;元素W的最外層電子數是次外層的2.5倍,W為N元素;X最外層電子數是電子層數的3倍,X為O元素;元素Z的單質,通常為黃綠色氣體,與Y的最高價氧化物的水化物反應的產物可作漂白劑和消毒劑,Z為Cl元素;
(2)實驗室制Cl2的原理為:![]() ;
;
(3)X的氫化物為H2O,則Cl2與H2O反應的化學方程式為:![]() ,因干燥的氯氣沒有漂白性,所以干燥的有色布條在氯氣中不褪色;
,因干燥的氯氣沒有漂白性,所以干燥的有色布條在氯氣中不褪色;
(4)Y的最高價氧化物的水化物為NaOH,則Z單質與Y的最高價氧化物的水化物發生反應的化學方程式為![]() ;當反應1molCl2時,轉移1mol電子,該反應中2mol Cl2完全反應時轉移2NA個電子;
;當反應1molCl2時,轉移1mol電子,該反應中2mol Cl2完全反應時轉移2NA個電子;
(5)W的氫化物為NH3,實驗室制備氨氣的化學方程式為![]() 。
。


科目:高中化學 來源: 題型:
【題目】一定溫度下,在固定容積的密閉容器中,可逆反應:mA(g)+nB(g)![]() pCg)+qD(g),當m、n、p、q為任意正整數時,下列狀態:①體系的壓強不再發生變化,②體系的密度不再發生變化,③各組分的物質的量濃度不再改變,④各組分的質量分數不再改變,⑤反應速率vA:vB:vC:vD=m:n:p:q,其中,能說明反應已達到平衡的是( )
pCg)+qD(g),當m、n、p、q為任意正整數時,下列狀態:①體系的壓強不再發生變化,②體系的密度不再發生變化,③各組分的物質的量濃度不再改變,④各組分的質量分數不再改變,⑤反應速率vA:vB:vC:vD=m:n:p:q,其中,能說明反應已達到平衡的是( )
A.只有③④B.②③④C.①②③④D.①②③④⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室制備溴苯的反應裝置如下圖所示,關于實驗操作或敘述錯誤的是

A. 向圓底燒瓶中滴加苯和溴的混合液前需先打開K
B. 實驗中裝置b中的液體逐漸變為淺紅色
C. 裝置c中的碳酸鈉溶液的作用是吸收溴化氫
D. 反應后的混合液經稀堿溶液洗滌、結晶,得到溴苯
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素X、Y、Z、W在元素周期表中的相對位置如圖所示,其中W原子的原子序數是其最外層電子數的三倍,下列說法正確的是( )
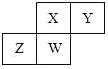
A.原子半徑:W>Z>Y>X
B.最高價氧化物對應水化物的酸性:Z>W>X
C.最簡單氣態氫化物的熱穩定性:Y>X>W>Z
D.元素X、Y、Z、W的最高化合價分別與其主族序數相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一個2 L的密閉容器中,加入3 mol A和1 mol B,發生下述反應:3A(g)+B(g)![]() 2C(g)+3D(s),5 min達到平衡時,C的濃度為0.6 mol/L。
2C(g)+3D(s),5 min達到平衡時,C的濃度為0.6 mol/L。
(1)達到平衡時,A的轉化率為________,此溫度下的平衡常數K=________。
(2)維持容器的溫度不變,若縮小容器的體積,則平衡將向________(填“正反應方向移動”“逆反應方向移動”或“不移動”)。
(3)維持容器的體積和溫度不變,向密閉容器中加入氦氣,達到新平衡時,B、C的濃度之比![]() 將________(填“增大”、“減小”或“不變”)。
將________(填“增大”、“減小”或“不變”)。
(4)當增加A的濃度,B的轉化率________;若將C分離出來,化學平衡常數________。(填“增大”、“減小”或“不變”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關圖像的說法正確的是

A. 圖甲表示:向某明礬溶液中逐滴加入NaOH溶液至過量,生成沉淀的物質的量與滴加NaOH溶液體積的關系
B. 圖乙表示:向含等物質的量的NaOH和Na2CO3的混合溶液中逐滴加入稀鹽酸至過量,生成氣體的體積與滴加HCl溶液體積的關系
C. 圖丙表示:在稀硝酸溶液中逐漸加入鐵粉至過量,溶液中Fe3+物質的量與逐漸加入鐵粉物質的量的變化關系
D. 除去混在硝酸鉀中少量的氯化鈉可用“蒸發濃縮、趁熱過濾”的方法
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】100℃時,向某恒容密閉容器中加入1.6 mol ·L-1的Q后會發生如下反應:2Q(g) ![]() M(g) 。其中M的物質的量濃度隨時間的變化如圖所示。
M(g) 。其中M的物質的量濃度隨時間的變化如圖所示。
下列說法錯誤的是
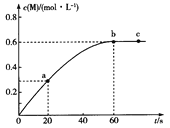
A.從反應開始到剛達到平衡時間段內,v(Q)=0.02 mol·L-1·s-1
B.a、b兩時刻生成Q的速率:v(a)<v(b)
C.用Q濃度變化值表示的ab、bc兩個時段內的反應速率:v(ab)>v(bc)=0
D.其他條件相同,起始時將0. 2 mol·L-1氦氣與Q混合,則反應達到平衡所需時間少于60 s
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖是在實驗室進行氨氣快速制備與性質實驗的組合裝置,部分固定裝置未畫出。
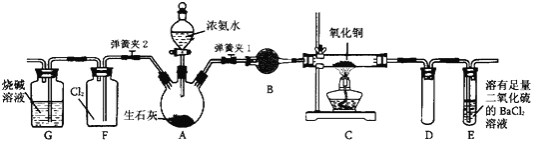
(1)在組裝好裝置后,若要檢驗A~E裝置的氣密性,其操作是首先____,然后微熱A,觀察到E中有氣泡冒出,移開酒精燈或松開雙手,E中導管有水柱形成,說明裝置氣密性良好。
(2)裝置B中盛放的試劑是________。
(3)點燃C處酒精燈,關閉彈簧夾2,打開彈簧夾l,從分液漏斗放出濃氨水至浸沒燒瓶中固體后關閉分液漏斗,稍候片刻,裝置C中黑色固體逐漸變紅,裝置E中溶液里出現大量氣泡,同時還可能產生的現象是________;從E中逸出液面的氣體可以直接排入空氣,請寫出在C中發生反應的化學方程式:________。
(4)當C中固體全部變紅色后,關閉彈簧夾1,慢慢移開酒精燈,待冷卻后,稱量C中固體質量,若反應前固體質量為16 g,反應后稱重固體質量減少2.4 g,通過計算確定該固體產物的成分是________(用化學式表示)。
(5)在關閉彈簧夾1后,打開彈簧夾2,殘余氣體進入F中,很快發現裝置F中產生白煙,同時發現G中溶液迅速倒吸流入F中。請寫出產生白煙的化學方程式:________,迅速產生倒吸的原因是________。
(6)為了汪明一水合氨是弱堿,甲、乙兩同學分別設計以下實驗進行探究。
①甲同學用pH試紙測得室溫下0.l mol/L氨水pH為10,則認定一水合氨是弱電解質,理由是________。
②乙同學取出10 mL 0.1 mol/L氨水,滴入2滴酚酞試液,顯粉紅色,再加入NH4Cl晶體少量,觀察到的現象是________,則證明一水臺氨是弱電解質。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國明崇禎年間《徐光啟手跡》記載了《造強水法》 :“綠釩(FeSO47H2O)五斤,硝五斤,將礬炒去,約折五分之一,將二味同研細,次用鐵作鍋,…… 鍋下起火,取氣冷定,開壇則藥化為水……。用水入五金皆成水,惟黃金不化水中,加鹽則化。……強水用過無力……”。下列有關解釋錯誤的是
A.“將礬炒去,約折五分之一”后生成FeSO44H2O
B.該方法所造“強水”為硝酸
C.“惟黃金不化水中,加鹽則化”的原因是加人 NaCl溶液后氧化性增強
D.“強水用過無力”的原因是“強水”用過以后,生成了硝酸鹽溶液,其氧化性減弱
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com