
【題目】開發新能源是世界各國研究的共同課題。近年來,科學家正在探索鋁粉作為新能源的可能性,以期望鋁能成為石油的一種替代物。假如鋁作為一種普遍使用的新型能源被開發利用,下列關于其有利因素的說法中,你認為錯誤的是( )
A. 鋁質輕,便于運輸、貯存且安全
B. 鋁燃燒時放出的熱量大,且燃燒后產物對環境的污染容易得到有效的控制
C. 在地球上,鋁礦資源比較豐富
D. 現代電冶鋁的工業技術已為鋁作為新能源奠定了重要基礎
科目:高中化學 來源: 題型:
【題目】利用海水制取氯氣、燒堿、溴及鎂等工藝示意圖如下:
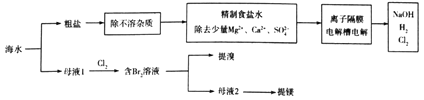
下列說法正確的是
A. “精制食鹽水”時藥品使用順序為Na2CO3(aq)、NaOH(aq)、BaCl2(aq)及鹽酸
B. 使用離子隔膜電解槽電解飽和食鹽水時,其中的“隔膜”是“陽離子交換膜”
C. 工業上“母液1”氧化得到“含Br2溶液”后可直接用CCl4萃取,然后蒸餾得粗溴
D. “母液2”需經過加石灰乳生成沉定Mg(OH)2、過濾、鹽酸溶解,然后直接電解得到鎂
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)已知NaHA水溶液呈堿性。
①用離子方程式表示NaHA水溶液呈堿性的原因:______________________________。
②在NaHA水溶液中各離子濃度的大小關系是:______________________________。
(2)25℃,兩種酸的電離平衡常數如表.
Ka1 | Ka2 | |
H2SO3 | 1.3×10﹣2 | 6.3×10﹣8 |
H2CO3 | 4.2×10﹣7 | 5.6×10﹣11 |
①HSO3﹣的電離平衡常數表達式K=______。
②H 2SO3溶液和NaHCO3溶液反應的主要離子方程式為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】右圖為一種微生物燃料電池結構示意圖,關于該電池敘述正確的是
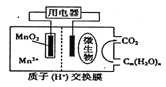
A. 正極反應式為MnO2+4H++2e-===Mn2++2H2O
B. 微生物所在電極區放電時發生還原反應
C. 放電過程中,H+從正極區移向負極區
D. 若用該電池給鉛蓄電池充電,MnO2電極質量減少8.7g,則鉛蓄電池陰極增重9.6g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表的一部分,有關說法正確的是
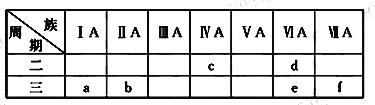
A. e的氫化物比d的氫化物穩定
B. a、b、e三種元素的原子半徑:e>b>a
C. c、e、f的最高價氧化物對應的水化物的酸性依次增強
D. 六種元素中,c元素單質的化學性質最活潑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應Fe+H2SO4═FeSO4+H2↑的能量變化趨勢如圖所示: 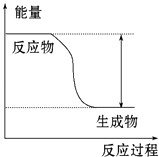
(1)該反應為反應(填“吸熱”或“放熱”).
(2)若要使該反應的反應速率加快,下列措施可行的是(填字母).
A.改鐵片為鐵粉
B.改稀硫酸為98%的濃硫酸
C.升高溫度
(3)若將上述反應設計成原電池,銅為原電池某一極材料,則銅為(填“正”或“負”)極.銅片上的現象為該極上發生的電極反應為 , 外電路中電子由極(填“正”或“負”,下同)向極移動.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知4NH3 + 5O2 = 4NO + 6H2O,若反應速率分別是ν(NH3)、ν(O2)、ν(NO)、ν(H2O氣)(單位:molL-1min-1)。下列關系正確的是 ( )
A. 4/5ν(NH3)=ν(O2) B. 5/6ν(O2)=ν(H2O)
C. 2/3ν(NH3)=ν(H2O) D. 4/5ν(O2)=ν(NO)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將5.4gAl投入到200.0mL 2.0mol/L的某溶液中,下列說法正確的是( )
A.若該溶液為Ba(OH)2 , 則充分反應后金屬有剩余
B.若該溶液為H2SO4 , 則充分反應后金屬有剩余
C.若該溶液分別為H2SO4、NaOH,則兩者產生的氫氣的物質的量相等
D.若該溶液為碳酸,則產生氫氣后金屬有剩余
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com