
【題目】某興趣小組研究含鐵元素的鹽類物質的制備、保存和性質。
實驗I. 配制FeCl2溶液:向0.1 mol·L-1 FeCl3溶液中加入足量鐵粉,充分振蕩,備用。
(1)FeCl3溶液與鐵粉反應的離子方程式是__________。
(2)在老師的指導下,配制的FeCl2溶液底部仍保留一層鐵粉,請說明該操作的必要性__________。
實驗II. 通過Fe(NO3)2的性質實驗,探究試劑添加順序的不同對現象和反應的影響。
實驗 | 試劑及操作 | 現象 | |
試管 | 滴管 | ||
| 0.1 mol/L Fe(NO3)2溶液 | 實驗i: 先滴加1.0 mL 0.5 mol·L-1 NaOH溶液; 再滴加1.5mL 1.0 mol·L-1 H2SO4溶液 | i. 滴加NaOH溶液后__________;加酸后溶液變為黃色 |
實驗ii: 先滴加1.5 mL 1.0 mol·L-1 H2SO4溶液; 再滴加1.0 mL 0.5 mol·L-1 NaOH溶液 | ii. 加酸時溶液無明顯現象;加堿后溶液依然沒有明顯變化 | ||
(3)實驗i中滴加NaOH溶液后出現的一系列現象是__________;請用化學或離子方程式說明Fe(NO3)2溶液中滴加堿溶液后出現此系列現象的原因__________、__________。
(4)探究實驗ii中先滴加H2SO4溶液時Fe(NO3)2溶液中是否發生了反應:
A. 向1.0 mL 0.1 mol·L-1 Fe(NO3)2溶液中__________(填寫具體實驗方法),溶液立即變紅,說明加酸時溶液中發生了反應,生成了Fe3+。
B. 推測溶液中產生Fe3+的可能原因有兩種:
a. 酸性條件下,__________;
b. 酸性條件下,Fe2+可能被空氣中的O2氧化,寫出相應的離子方程式:___________。
【答案】2Fe3++Fe=3Fe2+ Fe2+具有還原性,易被氧氣氧化為Fe3+,加鐵粉可抑制Fe3+的生成 生成白色沉淀迅速變成灰綠色,最后變成紅褐色 Fe2++2OH-=Fe(OH)2↓ 4Fe(OH)2+O2+2H2O=4Fe(OH)3 滴加KSCN溶液,沒有明顯現象,再向其中滴加1.5 mL 1.0 mol· L-1 H2SO4溶液 Fe(NO3)2溶液中的Fe2+被NO3-氧化 4Fe2++O2+4H+=4Fe3++2H2O
【解析】
(1)FeCl3溶液與鐵粉反應,Fe3+被Fe還原生成Fe2+。
(2)配制的FeCl2溶液底部仍保留一層鐵粉,一旦生成Fe3+,可被Fe還原。
(3)實驗i中滴加NaOH溶液后,起初生成Fe(OH)2,最后轉化為Fe(OH)3。
(4)A.向1.0 mL 0.1 mol·L-1 Fe(NO3)2溶液中,加酸后生成Fe3+,則應加入檢驗Fe3+的試劑。
B.推測溶液中產生Fe3+的可能原因有兩種:
a. 酸性條件下,NO3-表現氧化性;
b. 酸性條件下,Fe2+可能被空氣中的O2氧化,生成Fe3+和H2O。
(1)FeCl3溶液與鐵粉反應,Fe3+被Fe還原生成Fe2+,離子方程式是2Fe3++Fe=3Fe2+。答案為:2Fe3++Fe=3Fe2+;
(2)配制的FeCl2溶液底部仍保留一層鐵粉,一旦生成Fe3+,可被Fe還原,該操作的必要性是Fe2+具有還原性,易被氧氣氧化為Fe3+,加鐵粉可抑制Fe3+的生成。答案為:Fe2+具有還原性,易被氧氣氧化為Fe3+,加鐵粉可抑制Fe3+的生成;
(3)實驗i中滴加NaOH溶液后,出現的一系列現象是生成白色沉淀迅速變成灰綠色,最后變成紅褐色;Fe(NO3)2溶液中滴加堿溶液后出現此系列現象的原因是Fe2++2OH-=Fe(OH)2↓、4Fe(OH)2+O2+2H2O=4Fe(OH)3。答案為:生成白色沉淀迅速變成灰綠色,最后變成紅褐色;Fe2++2OH-=Fe(OH)2↓;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)A.向1.0 mL 0.1 mol·L-1 Fe(NO3)2溶液中,加酸后生成Fe3+,則應加入檢驗Fe3+的試劑,具體實驗方法為滴加KSCN溶液,沒有明顯現象,再向其中滴加1.5 mL 1.0 mol· L-1 H2SO4溶液。答案為:滴加KSCN溶液,沒有明顯現象,再向其中滴加1.5 mL 1.0 mol· L-1 H2SO4溶液;
B.推測溶液中產生Fe3+的可能原因有兩種:
a. 酸性條件下,Fe(NO3)2溶液中的Fe2+被NO3-氧化;答案為:Fe(NO3)2溶液中的Fe2+被NO3-氧化;
b. 酸性條件下,Fe2+可能被空氣中的O2氧化,生成Fe3+和H2O,離子方程式為4Fe2++O2+4H+=4Fe3++2H2O。答案為:4Fe2++O2+4H+=4Fe3++2H2O。


 孟建平小學滾動測試系列答案
孟建平小學滾動測試系列答案科目:高中化學 來源: 題型:
【題目】微生物電池是指在微生物的作用下將化學能轉化為電能的裝置,其工作原理如圖所示。下列有關微生物電池的說法錯誤的是( )

A. 微生物促進了反應中電子的轉移
B. 正極反應中有CO2生成
C. 質子通過交換膜從負極區移向正極區
D. 電池總反應為C6H12O6+6O2===6CO2+6H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用氨氣脫硝![]() 除
除![]() 是大氣污染防治研究的熱點,脫硝過程中涉及的反應為:
是大氣污染防治研究的熱點,脫硝過程中涉及的反應為:
主反應:![]()
副反應:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905.5KJ/mol
②4NH3(g)+4O2(g)=2N2O(g)+6H2O(g) △H=-1104.9KJ/mol
③4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=-1269.0KJ/mol
回答下列問題:
(1)主反應的△H為______
(2)如圖所示,保持其它條件相同,使用兩種不同的催化劑,主反應NO的轉化率與溫度關系如圖所示:
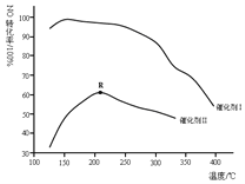
①選用催化劑I的優勢有______![]() 寫出一點
寫出一點![]()
②R點對應的溫度為2100C,低于2100C,NO的轉化率是不是對應溫度下的平衡轉化率,請作出判斷并寫出理由______.
(3)常溫下,在通入氧氣的條件下用![]() 的NaOH溶液吸收NO也可實現脫硝
的NaOH溶液吸收NO也可實現脫硝![]() 產物主要為
產物主要為![]() 和
和![]() ,已知反應后溶液的
,已知反應后溶液的![]() ,溶液中
,溶液中![]() 濃度為5.6×10-2mol/L,忽略反應過程中溶液體積變化,
濃度為5.6×10-2mol/L,忽略反應過程中溶液體積變化,![]() 的電離平衡常數為5.1×10-4,則:
的電離平衡常數為5.1×10-4,則:
①c(NO2-)c(OH-)/c(HNO2)=______![]()
②某溶液中c(NO2-)=1.0×10-6mol/L,取該溶液5mL,加入一滴![]() 的硝酸銀溶液
的硝酸銀溶液![]() 一滴為
一滴為![]() ,通過計算說明能否產生沉淀______[Ksp(AgNO2)=2×10-8]
,通過計算說明能否產生沉淀______[Ksp(AgNO2)=2×10-8]
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各溶液中,離子的物質的量濃度關系正確的是
A.pH=4的醋酸中:c(H+)= 0.4mol·L-1
B.飽和碳酸氫鈉溶液中(已知碳酸氫鈉溶液呈堿性):c(Na+)= c(HCO3-)
C.飽和食鹽水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-)
D.pH=12的純堿溶液中:c(OH-)=1.0×10-12mol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉛蓄電池是常用的化學電源,其電極材料分別是Pb和PbO2,電解液為稀硫酸。放電時,該電池總反應式為:Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O。請根據上述情況判斷:
2PbSO4+2H2O。請根據上述情況判斷:
(1)該蓄電池的負極材料是_________,放電時發生_________(填“氧化”或“還原”)反應。
(2)該蓄電池放電時,電解質溶液的酸性_________(填“增大”、“減小”或“不變”)。
(3)已知硫酸鉛為不溶于水的白色固體,生成時附著在電極上。試寫出該電池放電時,正極的電極反應_______________________________________(用離子方程式表示)。
(4)氫氧燃料電池具有啟動快、效率高等優點,其能量密度高于鉛蓄電池。若電解質為H2SO4溶液,則氫氧燃料電池的正極反應式為__________________________________。
(5)鉛的電解精煉是工業上實現廢鉛回收以及粗鉛提純的重要手段。鉛的電解精煉在由PbSiF6和H2SiF6兩種強電解質組成的水溶液中進行。從還原爐中產出的某粗鉛成分如下表所示:
成分 | Pb | Cu | Ag | Fe | Zn | Sn | 其它 |
% | 97.50 | 1.22 | 0.12 | 0.15 | 0.09 | 0.64 | 0.28 |
①電解精煉時陽極泥的主要成分是______(元素符號)。
②電解過程中,粗鉛表面會生成SiF6氣體,寫出該電極反應式________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】S2Cl2是橙黃色液體,少量泄漏會產生窒息性氣體,噴水霧可減慢其揮發,并產生酸性懸濁液。其分子結構如圖所示。下列關于S2Cl2的說法中錯誤的是( )
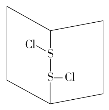
A.S2Cl2為非極性分子
B.分子中既含有極性鍵又含有非極性鍵
C.與S2Br2結構相似,熔、沸點S2Br2>S2Cl2
D.與水反應的化學方程式可能為2S2Cl2+2H2O===SO2↑+3S↓+4HCl
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】固體電解質有廣泛的用途。研究發現,晶體中有特殊結構為離子![]() 如
如![]() 提供快速遷移的寬敞通道或者有“點缺陷”,都能使其具有導電潛力。比如:圖
提供快速遷移的寬敞通道或者有“點缺陷”,都能使其具有導電潛力。比如:圖![]() 所示的鋰超離子導體
所示的鋰超離子導體![]() 和圖
和圖![]() 所示的有“點缺陷”的NaCl。
所示的有“點缺陷”的NaCl。
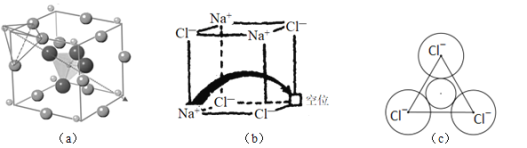
根據所學知識回答下列問題:
(1)在變化“Cl+e-→Cl-”過程中,所得電子填充在基態Cl的________能級,此過程會_______![]() 填“吸收”或“釋放”
填“吸收”或“釋放”![]() 能量。
能量。
(2)![]() 中B的雜化形式為__________,其等電子體為:___________
中B的雜化形式為__________,其等電子體為:___________![]() 任寫一種
任寫一種![]() 。與其VSEPR模型相同,且有1對孤電子對的相對分子質量最小的分子是____________。
。與其VSEPR模型相同,且有1對孤電子對的相對分子質量最小的分子是____________。
(3)圖![]() 所示晶胞中
所示晶胞中![]() 位于__________位置;若將晶體中形成寬敞通道的
位于__________位置;若將晶體中形成寬敞通道的![]() 換成
換成![]() ,導電能力會明顯降低,原因是_____________。
,導電能力會明顯降低,原因是_____________。
(4)圖![]() 中,若缺陷處填充了
中,若缺陷處填充了![]() ,則它____________
,則它____________![]() 填“是”或“不是”
填“是”或“不是”![]() 的晶胞,在NaCl晶體中,
的晶胞,在NaCl晶體中,![]() 填充在
填充在![]() 堆積而成的___________面體空隙中。
堆積而成的___________面體空隙中。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于晶體的說法正確的組合是( )
①分子晶體中都存在共價鍵
②在晶體中只要有陽離子就一定有陰離子
③金剛石、SiC、H2O、H2S晶體的熔點依次降低
④離子化合物中只有離子鍵沒有共價鍵,分子晶體中肯定沒有離子鍵
⑤CaTiO3晶體中(晶胞結構如圖所示)每個Ti4+和12個O2-相緊鄰
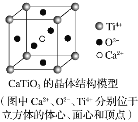
⑥SiO2晶體中每個硅原子與兩個氧原子以共價鍵相結合
⑦晶體中分子間作用力越大,分子越穩定
⑧氯化鈉溶于水時離子鍵被破壞
A. ①②③⑥B. ①②④C. ③⑤⑦D. ③⑤⑧
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】火力發電廠釋放出大量氮氧化合物(NOx)、SO2和CO2等氣體會造成環境問題。對燃煤廢氣進行脫硝、脫硫和脫碳等處理,可實現綠色環保、節能減排、廢物利用等目的。
(1)脫硝。利用甲烷催化還原NOx:
CH4(g)+ 4NO2(g)=4NO(g)+ CO2(g)+ 2H2O(g) △H1=-574 kJ/mol
CH4(g)+ 4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g) △H2=-1160 kJ/mol
甲烷直接將NO2還原為N2的熱化學方程式為___________。
(2)脫碳。將CO2轉化為甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
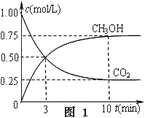

①在一恒溫恒容密閉容器中充入1 mol CO2和3 mol H2進行上述反應。測得CO2和CH3OH(g)濃度隨時間變化如圖1所示。回答:0~10 min內,氫氣的平均反應速率為___mol/(L·min);第10 min后,保持溫度不變,向該密閉容器中再充入1 mol CO2(g)和1 mol H2O(g),則平衡________(填“正向”、“逆向”或“不”)移動。
②如圖2,25℃時以甲醇燃料電池(電解質溶液為稀硫酸)為電源來電解300mL 某NaCl溶液,正極反應式為______。在電解一段時間后,NaCl溶液的pH值變為13(假設NaCl溶液的體積不變),則理論上消耗甲醇的物質的量為_____mol。
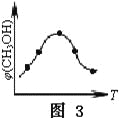
③取五份等體積的CO2和H2的混合氣體(物質的量之比均為1∶3),分別加入溫度不同、容積相同的恒容密閉容器中,發生上述反應,反應相同時間后,測得甲醇的體積分數φ(CH3OH)與反應溫度T的關系曲線如圖3所示,則上述CO2轉化為甲醇的反應的△H3____0(填“>”、“<”或“=”)。
(3)脫硫。燃煤廢氣經脫硝、脫碳后,與一定量氨氣、空氣反應,生成硫酸銨。硫酸銨水溶液呈酸性的原因是______(用離子方程式表示);室溫時,向(NH4)2SO4,溶液中滴人NaOH溶液至溶液呈中性,則所得溶液中微粒濃度大小關系c(Na+)_____c(NH3·H2O)。(填“>”、“<”或“=”)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com