
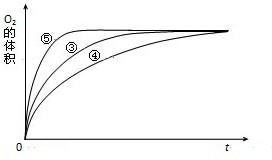
 (2011?順德區模擬)某實驗小組以H2O2分解為例,研究濃度、催化劑、溶液酸堿性對反應速率的影響.在常溫下按照如下方案完成實驗.
(2011?順德區模擬)某實驗小組以H2O2分解為例,研究濃度、催化劑、溶液酸堿性對反應速率的影響.在常溫下按照如下方案完成實驗.| 實驗編號 | 反應物 | 催化劑 |
| ① | 10mL2% H2O2溶液 | 無 |
| ② | 10mL5% H2O2溶液 | 無 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol?L-1FeCl3溶液 |


 閱讀快車系列答案
閱讀快車系列答案湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com