
某研究性學習小組為了探究醋酸的電離情況,進行了如下實驗。
探究濃度對醋酸電離程度的影響
用pH計測定25℃時不同濃度的醋酸的pH,其結果如下:
|
醋酸濃度(mol/L) |
0.0010 |
0.0100 |
0.0200 |
0.1000 |
0.2000 |
|
pH |
3.88 |
3.38 |
3.23 |
2.88 |
2.73 |
回答下列問題:
(1)寫出醋酸的電離方程式: 。
(2)醋酸溶液中存在的微粒有 。
(3)根據表中數據,可以得出醋酸是弱電解質的結論,你認為得出此結論的依據是 。
(4)從表中的數據,還可以得出另一結論:隨著醋酸濃度的減小,醋酸的電離程度(填增大、減小或不變) 。
(1)CH3COOH  CH3COO-
+ H+ (2分)
CH3COO-
+ H+ (2分)
(2)H2O, CH3COOH, CH3COO- , H+ , OH- (3分,少一個扣1分,)
(3)當醋酸濃度為0.001mol/L 時,溶液中的氫離子濃度小于0.001mol/L(3分)(其他合理即可)
(4)增大(2分)
【解析】
試題分析:
(1)CH3COOH是弱電解質,
CH3COOH  CH3COO- +
H+
CH3COO- +
H+
(2)醋酸溶液中存在醋酸和睡得部分電離,所以存在以下微粒:H2O, CH3COOH, CH3COO- , H+ , OH-
(3)當醋酸濃度為0.001mol/L 時,溶液中的氫離子濃度小于0.001mol/L,發生部分電離,為弱電解質。
(4)增大
考點:弱電解質的電離


科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
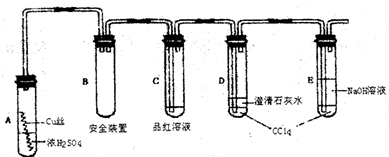
| ||
| ||
| ||
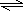 Cu(OH)2+2H+
Cu(OH)2+2H+ Cu(OH)2+2H+
Cu(OH)2+2H+查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
 “白鐵皮”具有較強的耐腐蝕性,是生產中常用的金屬材料之一.鍍鋅層猶如鐵皮的保護層,這層膜的厚度及均勻度也成了判斷鍍層質量的重要指標.某研究性學習小組為了測定鍍鋅鐵皮的厚度,設計了下面的實驗方案:
“白鐵皮”具有較強的耐腐蝕性,是生產中常用的金屬材料之一.鍍鋅層猶如鐵皮的保護層,這層膜的厚度及均勻度也成了判斷鍍層質量的重要指標.某研究性學習小組為了測定鍍鋅鐵皮的厚度,設計了下面的實驗方案:
| ||
| 2S×7.14 |
| ||
| 2S×7.14 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、鎂只與FeCl3溶液中的Fe3+直接反應 | B、氣泡是鎂與FeCl3溶液中的水直接反應產生的 | C、紅褐色沉淀是鎂與水反應生成的Mg(OH)2與Fe3+反應所得 | D、汽泡是鎂與FeCl3水解生成的鹽酸反應產生的 |
查看答案和解析>>
科目:高中化學 來源: 題型:
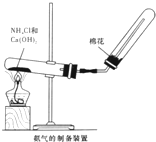 某研究性學習小組為了制取氨氣和探究氨氣的有關性質,進行了下列實驗.
某研究性學習小組為了制取氨氣和探究氨氣的有關性質,進行了下列實驗.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com