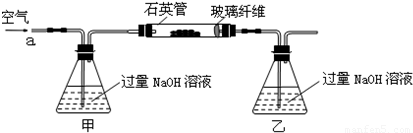
解:(1)空氣中含有二氧化碳,能和乙中的氫氧化鈉反應生成碳酸鈉,碳酸鈉和氯化鋇反應生成碳酸鋇導致沉淀量增大,從而導致干擾硫元素的測定,所以要把空氣中二氧化碳除去,用氫氧化鈉或氫氧化鉀溶液除去即可,所以甲中盛放的是氫氧化鈉溶液或氫氧化鉀溶液;乙中二氧化硫和氫氧化鈉反應生成亞硫酸鈉,離子方程式為 SO
2+2OH
-=SO
32-+H
2O,亞硫酸鈉和氧氣反應生成硫酸鈉,離子方程式為2SO
32-+O
2=2SO
42-,
故答案為:除去空氣中的CO
2,使乙裝置中的溶液只吸收黃鐵礦煅燒產生的SO
2;使乙裝置中的溶液只吸收黃鐵礦煅燒產生的SO
2;SO
2+2OH
-=SO
32-+H
2O;2SO
32-+O
2=2SO
42-;
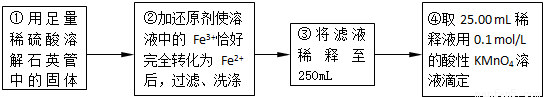
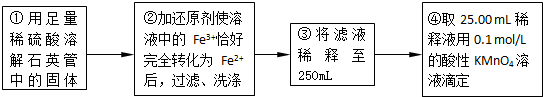
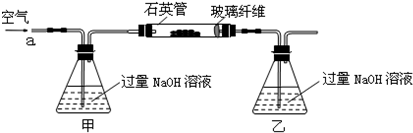
(2)為使亞硫酸根離子完全轉化為硫酸根離子,加入的雙氧水要足量;
故答案為:使SO
32-完全氧化為SO
42-;
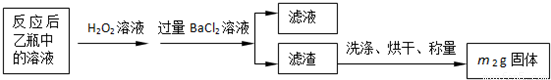
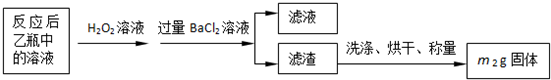
(3)最終所得沉淀是硫酸鋇,根據硫原子守恒得硫的質量,設硫的質量為x,
S-----BaSO
432g 233g
x m
2g
x=
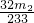
g
質量分數=
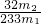
×100%;
故答案為:
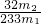
×100%.
(4)鐵和鐵離子反應生成的亞鐵離子物質的量增大,用高錳酸鉀物質的量增大,測定結果偏大;
故答案為:偏大;
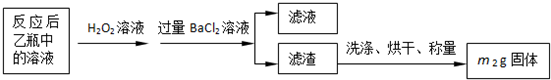
(5)④中取稀釋液25.00ml,溶液是酸性溶液,體積數據要求到小數點后兩位,需用的儀器是酸式滴定管,Ⅲ的步驟③中,一定物質的量濃度溶液的配制中,除了燒杯、玻璃棒、膠頭滴管外,還需要250mL容量瓶,容量瓶裝置圖為:
,故答案為:250mL容量瓶;
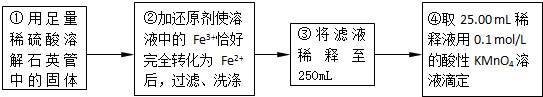
(6)依據實驗流程分析亞鐵離子被高錳酸鉀溶液滴定發生氧化還原反應,依據消耗的高錳酸鉀溶液體積平均數,結合氧化還原反應離子方程式計算25ml溶液中亞鐵離子的物質的量滴定亞鐵離子的濃度;滴定過程中高錳酸鉀溶液平均消耗體積=
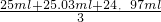
=25ml;
氧化還原反應為:5Fe
2++MnO
4-+8H
+=Mn
2++5Fe
3++4H
2O,設亞鐵離子物質的量為x,依據方程式計算得到:
5Fe
2++MnO
4-+8H
+=Mn
2++5Fe
3++4H
2O
5 1
x 0.1mol/L×0.025L
x=0.0125mol;
c(Fe
2+)=
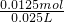
=0.5mol/L;
故答案為:0.5mol/L;
分析:(1)為防止二氧化碳的干擾,應將空氣中的二氧化碳用堿液除掉;二氧化硫能和氫氧化鈉反應生成鹽;亞硫酸根離子能被氧氣氧化生成硫酸根離子;
(2)為減少實驗誤差,最后使完全轉化成SO
42-,從而完全生成硫酸鋇沉淀;雙氧水足量時才能將亞硫酸根離子完全轉化;
(3)根據硫原子守恒計算硫鐵礦中硫的質量,從而計算其質量分數;
(4)鐵和鐵離子反應生成的亞鐵離子物質的量增大;
(5)根據一定物質的量濃度溶液的配制中各儀器的作用選取儀器;
(6)依據實驗過程和滴定實驗消耗的高錳酸鉀溶液體積的平均數,結合氧化還原反應離子方程式計算亞鐵離子物質的量,計算25ml溶液中亞鐵離子的濃度;
點評:本題考查了探究物質的含量實驗,滴定實驗的方法和計算,溶液配制方法和儀器的使用方法,根據元素化合物的性質來分析解答即可,難度不大,注意為防止空氣中二氧化碳的干擾.

 2Fe2O3+8SO2
2Fe2O3+8SO2  2Fe2O3+4SO2
2Fe2O3+4SO2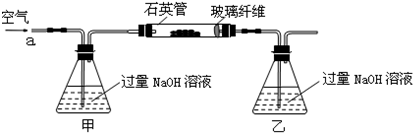
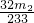 g
g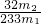 ×100%;
×100%;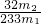 ×100%.
×100%. ,故答案為:250mL容量瓶;
,故答案為:250mL容量瓶;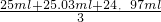 =25ml;
=25ml;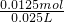 =0.5mol/L;
=0.5mol/L;





 2Fe2O3+8SO2
2Fe2O3+8SO2  2Fe2O3+4SO2
2Fe2O3+4SO2