
【題目】下列現象中,能說明鋁在氧氣中燃燒是化學變化的是( )
A. 發出耀眼白光B. 生成白色粉末C. 放出大量的熱D. 鋁的質量減少
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】高錳酸鉀是常用的氧化劑。工業上以軟錳礦(主要成分是MnO2)為原料制備高錳酸鉀晶體。中間產物為錳酸鉀。下圖是實驗室模擬制備KMnO4晶體的操作流程:

已知:錳酸鉀(K2MnO4)是墨綠色晶體,其水溶液呈深綠色,這是錳酸根離子(MnO42-)在水溶液中的特征顏色,在強堿性溶液中能穩定存在;在酸性、中性和弱堿性環境下,MnO42-會發生自身氧化還原反應,生成MnO4-和MnO2。
回答下列問題:
(1)KOH的電子式為______,煅燒KOH和軟錳礦的混合物應放在_______中加熱(填標號)。
a.燒杯 b.瓷坩堝 c.蒸發皿 d.鐵坩堝
(2)調節溶液pH過程中,所得氧化產物與還原產物的物質的量之比為______。
(3)趁熱過濾的目的是_______________________________。
(4)已知20℃時K2SO4、KCl、CH3COOK的溶解度分別為11.1g、34g、217g,則從理論上分析,選用下列酸中__________(填標號),得到的高錳酸鉀晶體純度更高。
a.稀硫酸 b.濃鹽酸 c.醋酸 d.稀鹽酸
(5)產品中KMnO4的定量分析:
①配制濃度為0.1250mg·mL-1的KMnO4標準溶液100mL。
②將上述溶液稀釋為濃度分別為2.5、5.0、7.5、10.0、12.5、15.0(單位:mg·L-1)的溶液,分別測定不同濃度溶液對光的吸收程度,并將測定結果繪制成曲線如下。

③稱取KMnO4樣品(不含K2MnO4)0.1250g按步驟①配得產品溶液1000mL,取10mL稀釋至100mL,然后按步驟②的方法進行測定,兩次測定所得的吸光度分別為0.149、0.151,則樣品中KMnO4的質量分數為____。
(6)酸性KMnO4溶液與FeSO4溶液反應的離子方程式為_______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用CO和H2在催化劑的作用下合成甲醇,發生如下反應:CO(g)+2H2(g) ![]() CH3OH(g)。在體積一定的密閉容器中按物質的量之比1∶2充入CO和H2,測得平衡混合物中CH3OH的體積分數在不同壓強下隨溫度的變化情況如右圖所示。下列結論正確的是
CH3OH(g)。在體積一定的密閉容器中按物質的量之比1∶2充入CO和H2,測得平衡混合物中CH3OH的體積分數在不同壓強下隨溫度的變化情況如右圖所示。下列結論正確的是
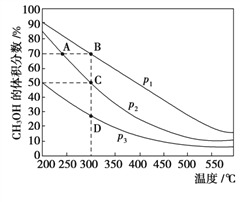
A. 該反應的ΔH>0 B. 平衡常數:K(C)< K(D)
C. 壓強:p1>p2 D. 達到平衡時,反應速率:v(A)> v(B)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是元素周期表的一部分,表中所列字母分別代表一種元素

回答下列問題:
(1)h元素的名稱是_________,九種元素中金屬性最強的是_________(填元素符號)。
(2)f的最高價氧化物對應的水化物的化學式___________(填化學式)。
(3)b、c、d、e的原子半徑依次___________(填增大或減小)。
(4)e、h元素的氫化物中,熱穩定性大的是_________(填氫化物的化學式)。
(5)工業上冶煉g元素的單質的化學方程式_______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知反應:3A(g)+B(g)![]() 2C(g)+2D(g) △H<0。右圖中曲線a、b分別表示在不同條件下,A與B反應時,D的體積分數隨時間t的變化情況。若想使曲線b(實線)變為曲線a(虛線),可采用的措
2C(g)+2D(g) △H<0。右圖中曲線a、b分別表示在不同條件下,A與B反應時,D的體積分數隨時間t的變化情況。若想使曲線b(實線)變為曲線a(虛線),可采用的措
施是( )
①增大A的濃度 ②升高溫度
③增大D的濃度④加入催化劑
⑤恒溫下,縮小反應容器的體積
⑥加入稀有氣體,保持容器內壓強不變

A. ①②③ B. ④⑤ C. ③④⑤ D. ④⑤⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.通式相同的不同物質一定屬于同系物
B.完全燃燒某有機物,生成CO2 和 H2O 的物質的量之比為1 :1,該有機物只可能是烯烴或環烷烴
C.分子式相同而結構不同的化合物一定互為同分異構體
D.符合通式CnH2n-2(n≥3)的有機物一定是炔烴
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硝酸銨可用作化肥、軍用炸藥、殺蟲劑、冷凍劑,工業制取硝酸銨的工藝流程如下:

(1)N2分子的電子式為_____,NH3分子中含有的化學鍵類型是____________。
(2)乙裝置中發生反應的化學方程式是_________,標準狀況下,該反應生成2.24LNO氣體轉移的電子數目為______。
(3)生產硝酸排放的尾氣中常含有NO、NO2,可用以下兩種方法處理:
方法一:堿液吸收法。寫出用其氧化鈉溶液吸收NO、NO2生成亞硝酸鈉的離子方程式_________。
方法二:甲烷吸收法。在恒壓條件下,將一定量的CH4和NO2兩種氣體置于密閉容器中,發生CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) ΔH<0,提高NO2轉化率的措施有______(填字母)。
N2(g)+CO2(g)+2H2O(g) ΔH<0,提高NO2轉化率的措施有______(填字母)。
A.增加催化劑表面積 B.減小投料比:n(NO2)/n(CH4)
C.增大壓強 D.升高溫度
(4)配制100mL0.1mol·L-1NH4NO3溶液所需要的玻璃儀器有燒杯、玻璃棒、量筒、膠頭滴管和______。
(5)25℃時,下列關于硝酸銨溶液中的離子濃度關系不正確的是_____ 。
A.Kw/c(H+)>1×10-7mol·L-1 B.c(NO3-)>c(NH4+)>c(H+)>c(OH-)
C.c(H+)=c(OH-)+c(NH3·H2O) D.c(NH4+)+c(H+)=c(NO3-)+c(OH-)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com