
【題目】在容積一定的密閉容器中,置入一定量的 NO(g)和足量C(s),發生反應 C(s)+2NO(g)![]() CO2(g)+N2(g),平衡狀態時 NO(g)的物質的量濃度 c(NO)與溫度 T 的關系如圖所示。則下列說法中正確的是( )
CO2(g)+N2(g),平衡狀態時 NO(g)的物質的量濃度 c(NO)與溫度 T 的關系如圖所示。則下列說法中正確的是( )
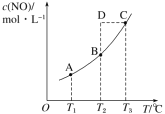
A.該反應的 ΔH>0B.若該反應在 T1、T2 時的平衡常數分別為 K1、K2,則 K1<K2
C.在 T3 時,若混合氣體的密度不再變化,則可以判斷反應達到平衡狀態 CD.在 T2 時,若反應體系處于狀態D,則此時一定有 v 正<v 逆
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】環戊噻嗪是治療水腫及高血壓的藥物,其中間體G的一種合成路線如下:

回答下列問題:
(1)A的化學名稱是_____________。B中含有官能團的名稱為_____________。
(2)反應②的反應類型是________________。
(3)C的結構簡式為_______________。
(4)G與新制Cu(OH)2反應的化學方程式為___________________。
(5)X與E互為同分異構體,X中含有六元碳環,且X能與NaOH溶液反應,則符合條件的X的結構簡式為_________________。
(6)設計由1,3-丙二醇和丙二酸二乙酯制備 的合成路線(其他試劑任選)______________。
的合成路線(其他試劑任選)______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某100mL混合液中,HNO3和H2SO4的物質的量濃度分別為0.1mol/L和0.4mol/L。向該混合液中加入1.92g銅粉,加熱使反應發生完全。下列說法正確的是(忽略反應前后溶液體積變化)( )
A.所得溶液中c(Cu2+)=0.225mol/L
B.所得溶液中c(H+)=0.5mol/L
C.所得氣體在標準狀況下的體積為0.448L
D.反應中轉移0.06mol的電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在25℃時,將1.0L c mol·L-1 CH3COOH溶液與0.1mol NaOH固體混合,使之充分反應。然后向該混合溶液中通入HCl氣體或加入NaOH固體(忽略體積和溫度變化),溶液pH隨通入(或加入)物質的物質的量的變化如圖所示。下列敘述錯誤的是( )
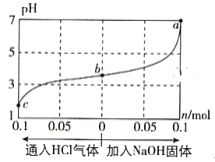
A. 水的電離程度:a>b>c
B. c點對應的混合溶液中:c(CH3COOH)>c(Na+)>c(OH-)
C. a點對應的混合溶液中:c(Na+)=c(CH3COO-)
D. 該溫度下,CH3COOH的電離平衡常數![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法錯誤的是( )
A.銀氨溶液的配制:在潔凈的試管中加入2%AgNO3溶液1~2mL,逐滴加入2%稀氨水,邊滴邊振蕩,至沉淀恰好溶解時為止
B.丙醛在催化劑存在下與氫氣反應是還原反應,甲醛與新制的Cu(OH)2發生的是氧化反應
C.為了鑒別己烯、甲苯和丙醛,可以使用新制Cu(OH)2懸濁液與溴水
D.乙醇的球棍模型為:![]() ,分子式為CH3CH2OH
,分子式為CH3CH2OH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機物的結構簡式為 。下列關于該有機物分子結構的說法中正確的是
。下列關于該有機物分子結構的說法中正確的是
A. 最多有18個原子在同一平面內 B. 最多有4個碳原子在一條直線上
C. 最多有12個碳原子在同一平面內 D. 所有原子都可能在同一平面內
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用廢舊鍍鋅鐵皮制備磁性Fe3O4膠體粒子及副產物ZnO,制備流程圖如下:
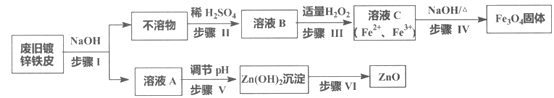
已知反應:①Zn+2NaOH=Na2ZnO2+H2↑ ②Zn(OH)2+2NaOH=Na2ZnO2+2H2O
回答下列問題:
(1)步驟I中的分離操作名稱是_______,溶液A中的溶質有_______(填化學式)。
(2)步驟III中反應的離子方程式是___________________________________。
(3)步驟IV中反應的離子方程式是____________________________。
(4)步驟V可選用的試劑是_______(填序號)。
a. NaOH溶液 b. 氨水 c. 鹽酸
(5)步驟VI的實驗操作是______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯堿工業是一種高耗能產業,一種將燃料電池與電解池組合的新工藝可節能30%以上,下圖是該工藝圖示(電極未標出)。
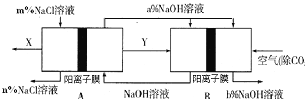
下列說法正確的是
A.X為H2,Y為Cl2
B.A池為電解池,且m<n
C.B池為燃料電池,且a<b
D.該工藝優點是燃料電池提供電能且能提高燒堿產品的濃度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業制得的氮化鋁(AlN)產品中常含有少量Al4C3、Al2O3、C等雜質。某同學設計如下實驗分別測定氮化鋁(AlN)樣品中AlN和Al4C3的質量分數(忽略NH3在強堿性溶液中的溶解)。
(1)實驗原理:
①Al4C3與硫酸反應可生成CH4;
②AIN溶于強酸產生銨鹽,溶于強堿生成氨氣,請寫出AlN與NaOH溶液反應的化學方程式:__________________________________________________________________
(2)實驗裝置(如圖所示,量氣管為堿式滴定管改裝)
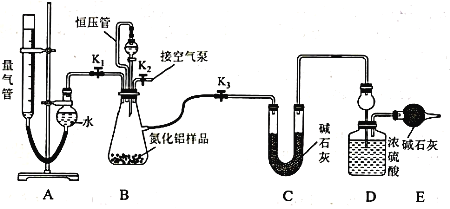
連好裝置后,首先應進行的操作是_____________________________________ 。
(3)實驗過程:稱得裝置D的初始質量為y g;稱取x g AlN樣品置于裝置B錐形瓶中,各裝置中加入相應藥品,重新連好裝置;讀取量氣管的初始讀數為a mL(量氣裝置左右液面相平)。
①欲首先測量Al4C3質量分數的有關數據,對K1、K2、K3三個活塞的操作是關閉活塞_______,打開活塞______。
②若無恒壓管,對所測氣體體積的影響是_______(填“偏大”、“偏小”或“無影響”)。
③量氣管中液面不再發生變化,說明反應已經結束。讀取讀數之前,應對量氣管進行的操作為 ______________________________________ ;若量氣管中的液面高于右側球形容器中的液面,所測氣體的體積_________(填“偏大”、“偏小”或“無影響”)。
④記錄滴定管的讀數為b mL(已知:該實驗條件下的氣體摩爾體積為Vm L· mol-1),則Al4C3的質量分數為___________(用可能含a、b、x、y、Vm的代數式表示)。
⑤測量AlN質量分數的數據:首先關閉活塞K1,打開活塞K3,通過分液漏斗加入過量NaOH溶液,與裝置B瓶內物質充分反應;反應完成后,___________________________(填該步應進行的操作),最后稱得裝置D的質量為z g。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com