
【題目】下列化學用語表達正確的是:
A. HCl 的電子式:![]() B. F-結構示意圖:
B. F-結構示意圖: ![]()
C. H2 燃燒的熱化學方程式: 2H2 (g) + O2 (g) = 2H2O (g) △H = - 571.6 kJ·mol-1D. Cl2 與水反應的離子方程式: Cl2 + H2O = 2H+ +Cl- + ClO-
科目:高中化學 來源: 題型:
【題目】在一定溫度下,反應![]() 達到反應限度的標志是:
達到反應限度的標志是:
A. 正、逆反應速率相等且都等于零
B. c(A2):c(B2):c(AB)= 1:1:2
C. A2、B2和AB的物質的量不再改變
D. 單位時間內消耗n molA2的同時生成2nmolAB
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于反應3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)的平衡常數,下列說法正確的是
Fe3O4(s)+4H2(g)的平衡常數,下列說法正確的是
A. K=![]()
B. K=![]()
C. 增大c(H2O)或減小c(H2),會使該反應平衡常數減小
D. 改變反應的溫度,平衡常數不一定變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NaClO2的漂白能力是漂白粉的4~5倍, NaClO2廣泛用于造紙工業、污水處理等。工業上生產NaClO2的工藝流程如下:
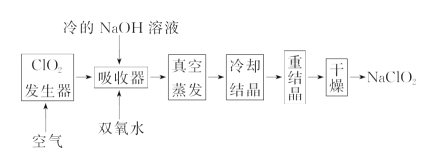
(1)ClO2氣體發生器中的反應為:2NaClO3+SO2+H2SO4===2ClO2+2NaHSO4。實際工業生產中,可用硫黃、濃硫酸代替原料中的SO2,其原因為____________(用化學方程式表示)。
(2)反應結束后,向ClO2發生器中通入一定量空氣的目的:________________________。
(3)吸收器中生成NaClO2的離子反應方程式為________________________________。
(4)CO和聯氨(N2H4)的性質及應用的研究是能源開發、環境保護的重要課題。
①用CO、O2和KOH溶液可以制成堿性燃料電池,則該電池反應的離子方程式為_______________。
②用CO、O2和固體電解質還可以制成如下圖所示的燃料電池,則電極d的電極反應式為__________。
(5)聯氨的性質類似于氨氣,將聯氨通入CuO濁液中,有關物質的轉化如圖所示。
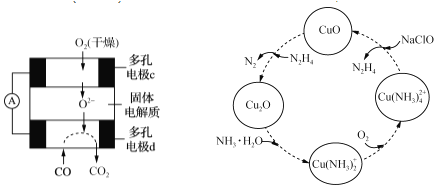
①在轉化過程中通入氧氣發生反應后,溶液的pH將________(填“增大”、“減小”或“不變”)。轉化中當有1 mol N2H4參與反應時,需要消耗O2的物質的量為________。
②加入NaClO時發生的反應為:
Cu(NH3)42++2ClO-+2OH-=Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
該反應需在80℃以上進行,其目的除了加快反應速率外,還有_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學在人類社會發展中發揮著重要作用,下列事實不涉及化學反應的是
A.利用廢棄的秸稈生產生物質燃料乙醇B.利用石油生產塑料、化纖等高分子材料
C.利用基本的化學原料生產化學合成藥物D.利用蒸餾法從海水中分離出淡水
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關乙烯和乙烷的說法中錯誤的是![]()
![]()
A. 乙烯是平面分子,乙烷分子中所有原子不可能在同一平面內
B. 溴的四氯化碳溶液和酸性![]() 溶液都可以鑒別乙烯和乙烷
溶液都可以鑒別乙烯和乙烷
C. 溴的四氯化碳溶液和酸性![]() 溶液都可以除去乙烷中混有的乙烯
溶液都可以除去乙烷中混有的乙烯
D. 乙烯的化學性質比乙烷的化學性質活潑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有關晶體的結構如圖所示,下列說法中不正確的是 ( )


A. 在NaCl晶體中,距Na+最近的Cl-形成正八面體
B. 在CaF2晶體中,每個晶胞平均占有4個Ca2+
C. 在金剛石晶體中,碳原子與碳碳鍵個數的比為1∶2
D. 該氣態團簇分子的分子式為EF或FE
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以下物質間的每步轉化通過一步反應能實現的是( )
A. Al-Al2O3-Al(OH)3-NaAlO2 B. Si-SiO2-H2SiO3-Na2SiO3
C. Cu-CuO-Cu(OH)2-CuSO4 D. Na-Na2O2-Na2CO3-NaOH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為驗證鹵素單質氧化性的相對強弱,某學習小組用下圖所示裝置進行實驗(夾持儀器已略去,氣密性已檢驗)。
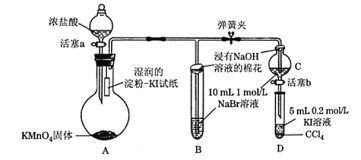
實驗過程:
Ⅰ. 打開彈簧夾,打開活塞a,滴加濃鹽酸。
Ⅱ. 當B和C中的溶液都變為黃色時,夾緊彈簧夾。
Ⅲ. 當B中溶液由黃色變為棕紅色時,關閉活塞a。
Ⅳ.……
回答問題:
(1)A中產生黃綠色氣體,其電子式是_____。實驗室在加熱條件下制取該氣體的離子方程式為_______。
(2)驗證氯氣的氧化性強于碘單質的實驗現象是____________。
(3)C中溶液發生反應的離子方程式是_______________。
(4)過程Ⅲ實驗的目的:甲同學認為試管B的作用就是吸收尾氣,防止多余Cl2污染空氣,因此B中盛裝的最佳試劑應該為________。
乙同學經分析認為,B中溶液由黃色變為棕紅色,發生反應的化學方程式為____________,以此說明C中_________,從而得出D中氧化I-的氧化劑必為Br2,因此B裝置是必不可少的。
(5)過程Ⅳ為:打開活塞b,將少量C中溶液滴入D中,關閉活塞b,取下試管D震蕩,靜置,觀察到的現象為___________,發生反應的離子方程式為_________。
(6)氯、溴、碘單質的氧化性逐漸減弱的本質原因:同主族元素從上到下_________,得電子能力逐漸減弱。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com