
【題目】堿性鋅錳干電池在放電時,電池的總反應方程式可以表示為: Zn+2MnO2 +2H2O = Zn(OH)2 +2MnOOH。電池放電時,負極上發生反應的物質是
A.Zn B.碳棒 C.MnO2 D.MnO2和H2O
【答案】A
【解析】
試題分析:根據總反應方程式可知Zn在反應中失去電子,發生氧化反應,所以作原電池的負極,MnO2得到電子,發生還原反應,作原電池的正極。因此答案是選項A。
考點:考查根據原電池反應原理確定電池的電極材料的知識
【題型】單選題
【結束】
17
【題目】在恒容隔熱容器中,下列說法可以證明可逆反應N2+3H2![]() 2NH3已達到平衡狀態的是( )
2NH3已達到平衡狀態的是( )
①1mol N≡N鍵斷裂的同時,有6mol N-H鍵斷裂
②v(H2)=0.9 mol·L-1·min-1,v(NH3)=0.6 mol·L-1·min-1
③保持其他條件不變時,體系氣體密度不再改變
④NH3、N2、H2的體積分數都不再改變
⑤體系溫度不再改變
A. ②③④ B. ①③⑤ C. ①④⑤ D. ③④⑤
【答案】C
【解析】①1mol N≡N鍵斷裂的同時,有6mol N-H鍵斷裂,說明正逆反應速率相等,反應達到了平衡狀態,故①選;②v(H2)=0.9 mol·L-1·min-1,v(NH3)=0.6 mol·L-1·min-1,因未說明二者表示的是正反應速率還是逆反應速率,則不能說明正逆反應速率相等,反應不一定達到平衡狀態,故②不選;③根據質量守恒可知,該反應在反應前后質量不變,又因容器恒容,所以反應體系的密度始終不變,則體系氣體密度不再改變不能說明反應達到平衡狀態,故③不選;④NH3、N2、H2的體積分數都不再改變,說明正逆反應速率相等,反應達到了平衡狀態,故④選;⑤因該反應是在恒容隔熱容器中進行,則體系溫度不再改變,說明反應達到了平衡狀態,故⑤選,綜上所述,答案選C。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】(題文)海帶含有豐富的碘,為了從海帶中提取碘,某研究性學習小組設計并進行了以下實驗:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
請填寫下列空白:
(1)步驟③和⑤的實驗操作名稱分別是________________、____________。
(2)步驟⑥的目的是從含碘苯溶液中分離出單質碘和回收苯,該步驟應選擇的實驗裝置是________,該裝置的操作名稱為__________。
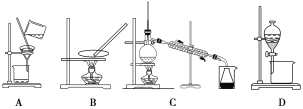
(3)步驟④反應的離子方程式是___________________________。
(4)請設計一個簡單的實驗方案,檢驗提取碘后的水溶液中是否還含有單質碘:______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】[化學一選修3:物質結構與性質](15 分)
鈾是原子反應堆的原料,常見鈾的化合物有UF4、UO2及(NH4)4[UO2(CO3)3等。
回答下列問題:
(1) UF4用Mg或Ca 還原可得金屬鈾。基態鈣原子的核外電子排布式為__________________;熔點:MgO(2852℃)高于CaO(2614℃),原因是_______________________________;金屬鈾的一種堆積方式為體心立方堆積,該堆積方式的空間利用率為_______________________________。
(2)已知:2UO2+5NH4HF2 ![]() 2UF4·NH4F+3NH3↑+ 4H2O↑,NH4HF2中含有的作用力是________(填選項字母)。
2UF4·NH4F+3NH3↑+ 4H2O↑,NH4HF2中含有的作用力是________(填選項字母)。
a.氫鍵 b.配位鍵 c.共價鍵 d.離子鍵 e.金屬鍵
(3)已知:3[(NH4)4[UO2(CO3)3] ![]() 3UO2+10NH3 ↑+9CO2 ↑+N2 ↑+9H2O↑
3UO2+10NH3 ↑+9CO2 ↑+N2 ↑+9H2O↑
①NH4+的空間構型為_____________________,與NH4+互為等電子體的分子或離子有_____(任寫兩種)。
②CO32-中碳原子的雜化軌道類型為___________________________。
③分解產物中屬于非極性分子的是____________________(填選項字母)。
a.NH3 b. CO2 C.N2 d. H2O
(4)UO2的晶胞結構及晶胞參數如圖所示:
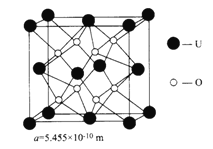
①晶胞中U 的配位數為__________________________。
②UO2晶體的密度為_____________g·cm-3(列出計算式即可。設NA表示阿伏加德羅常數的值)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.鏈節是高分子化合物中重復出現的結構單元,如聚乙烯的鏈節是CH2=CH2
B.丙烯和聚丙烯都能使溴水褪色
C.高分子化合物沒有固定的熔沸點
D.加聚反應生存環境高分子化合物的同時,還有H2O等小分子物質生成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列描述中正確的是 ( )
A. 純堿溶于熱水后去污效果增強,說明純堿的水解反應是吸熱反應
B. NH3(g) + HCl(g) = NH4Cl(s) 在較低溫度下能自發進行,說明該反應的ΔH>0
C. 500℃、30 MPa下,將7 g N2和3 g H2置于密閉容器中充分反應生成NH3(g),放熱19.3 kJ,其熱化學方程式為N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
D. 甲烷的燃燒熱(ΔH)為-890.3 kJ·mol-1,則甲烷燃燒的熱化學方程式可表示為CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
【答案】A
【解析】A. 純堿溶于熱水后去污效果增強,說明升高溫度促進了水解,使水解平衡正向移動,所以可以說明純堿的水解是吸熱反應,故A正確;B. 根據△G=△H-T△S可知,當△G小于0時反應自發進行,由于反應NH3(g) + HCl(g) = NH4Cl(s)是熵值減小的反應,所以如果該反應在較低溫度下能自發進行,則說明該反應的△H<0,故B錯誤;C.因合成氨的反應是可逆反應,所以無法確定將7 g N2和3 g H2置于密閉容器中充分反應后,生成了多少NH3(g),故無法計算該反應的焓變,故C錯誤;D. 燃燒熱指的是1mol純物質完全燃燒生成穩定的氧化物時所放出的能量,所以生成的水應為液態,即甲烷燃燒的熱化學方程式應表示為CH4(g)+2O2(g)= CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1,故D錯誤;答案選A。
【題型】單選題
【結束】
14
【題目】在0.1 mol·L-1的CH3COOH溶液中,要抑制醋酸電離,且c(H+)增大,應采取的措施是
A. 加水 B. 升溫 C. 加適量CH3COONa固體 D. 通適量HCl氣體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)現有a.BaCl2 b.金剛石 c.NH4Cl d.Na2SO4 e.干冰 f.碘片六種物質,按下列要求回答(若有多個選項的,多選錯選不給分):
①熔化時需要破壞共價鍵的是______, 熔點最高的是_______,熔點最低的是_______。
②屬于離子化合物的是________,只含有離子鍵的物質是________,含有兩種化學鍵的物質是_________,含有分子間作用力的是__________。
(2)看下圖回答下列問題
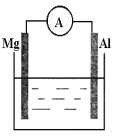
①若燒杯中溶液為稀硫酸,則觀察到的現象是___________,負極反應式為___________。
②若燒杯中溶液為氫氧化鈉溶液,則負極為_______(填Mg或Al),總反應方程式為__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,取pH=2的兩種二元酸H2A與H2B各1mL,分別加水稀釋,測得pH變化與加水稀釋倍數有如圖所示變化,則下列有關敘述正確的是( )
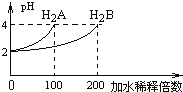
A. H2A為二元弱酸,稀釋前c(H2A)=0.005mol/L
B. NaHA水溶液中:c(Na+)+ c(H+)= 2c(A2-)+ c(OH-)
C. 含等物質的量的NaHA、NaHB的混合溶液中:c(Na+)= c(A2-)+ c(B2-)+ c(HB-)+ c(H2B)
D. pH=10的NaHB溶液中,離子濃度大小為:c(Na+)>c(HB-)>c(OH-)>c(B2-)>c(H2B)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】羥氨(NH2OH )為一元弱堿(25℃時,電高常數Kb=9.0×10-9),其電離方程式為NH2OH+H2O ![]() NH3OH++OH-。 25℃時,用0.100mol· L-1鹽酸滴定20mL0.100mol· L-1NH2OH溶液,滴定過程中水電離出來的H+濃度的負對數與鹽酸體積的關系如圖所示(已知:lg3=0.5) 。下列說法不正確的是( )
NH3OH++OH-。 25℃時,用0.100mol· L-1鹽酸滴定20mL0.100mol· L-1NH2OH溶液,滴定過程中水電離出來的H+濃度的負對數與鹽酸體積的關系如圖所示(已知:lg3=0.5) 。下列說法不正確的是( )
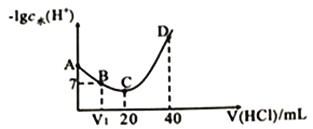
A. V1<10
B. A點對應溶液的pH=9.5
C. A 、B、C 、D四點對應的溶液中NH2OH電離常數相等
D. D點對應溶液中存在:c(H+)=c(OH-)+c(NH3OH+)+c(NH2OH )
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com