
【題目】可逆反應:2NO2![]() 2NO+O2 在恒容密閉容器中反應,達到平衡狀態的標志是( )
2NO+O2 在恒容密閉容器中反應,達到平衡狀態的標志是( )
①單位時間內生成n molO2的同時,生成2n molNO2
②單位時間內生成n molO2 的同時,生成2n mol NO
③用NO2、NO、O2 的物質的量濃度變化表示的反應速率的比為2 : 2 : 1的狀態
④混合氣體的顏色不再改變的狀態
⑤混合氣體的密度不再改變的狀態
⑥ 混合氣體的平均相對分子質量不再改變的狀態
A. ①④⑥ B. ②③⑤ C. ①③④ D. ①②③④⑤⑥
【答案】A
【解析】可逆反應2NO2![]() 2NO+O2 在恒容密閉容器中反應,①單位時間內生成n molO2的同時,生成2n molNO2 ,說明正反應速率和逆反應速率相等,達到平衡;②單位時間內生成n molO2 的同時,生成2n mol NO ,只有正反應速率,不能說明正反應速率和逆反應速率相等;③用NO2、NO、O2 的物質的量濃度變化表示的反應速率的比為2 : 2 : 1的狀態,不能說明正反應速率和逆反應速率相等;④混合氣體的顏色不再改變的狀態,說明反應混合物中各組分的濃度保持不變,達到平衡;⑤混合氣體的密度一直保持不變,所以密度不變不能說明達到平衡狀態;⑥ 該反應的正反應方向是氣體分子數增大的方向,反應過程中氣體的平衡相對對分子質量減小,所以當混合氣體的平均相對分子質量不再改變時達到平衡。綜上所述,達到平衡狀態的標志是①④⑥,選A。
2NO+O2 在恒容密閉容器中反應,①單位時間內生成n molO2的同時,生成2n molNO2 ,說明正反應速率和逆反應速率相等,達到平衡;②單位時間內生成n molO2 的同時,生成2n mol NO ,只有正反應速率,不能說明正反應速率和逆反應速率相等;③用NO2、NO、O2 的物質的量濃度變化表示的反應速率的比為2 : 2 : 1的狀態,不能說明正反應速率和逆反應速率相等;④混合氣體的顏色不再改變的狀態,說明反應混合物中各組分的濃度保持不變,達到平衡;⑤混合氣體的密度一直保持不變,所以密度不變不能說明達到平衡狀態;⑥ 該反應的正反應方向是氣體分子數增大的方向,反應過程中氣體的平衡相對對分子質量減小,所以當混合氣體的平均相對分子質量不再改變時達到平衡。綜上所述,達到平衡狀態的標志是①④⑥,選A。


科目:高中化學 來源: 題型:
【題目】下圖為利用肼(N2H4)一空氣燃料電池電解硫酸銅溶液的示意圖。下列說法正確的是( )
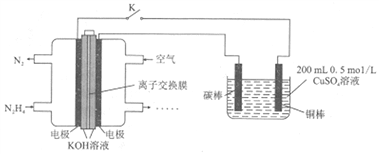
A. 左圖中離子交換膜為陽離子交換膜
B. 左圖負極反應式為:N2H4-6e-+4OH-=N2↑+4H2O
C. 閉合開關K一段時間后,左圖電池中電解質溶液的pH不變
D. 當右圖陰極上析出4.48L氣體(標準狀況)時,消耗0.15molN2H4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將一塊金屬鈉露置于空氣中,觀察到下列現象:
![]()
請回答下列問題:
(1)白色粉末的化學式是__________,過程②的化學方程式是_________。
(2)下列說法正確的是________。
A. 過程③為物理變化
B. 過程④是碳酸鈉吸收空氣中的CO2、水蒸氣形成了碳酸氫鈉
C. 過程⑤發生了分解反應
D. 整個變化過程中只有一個氧化還原反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下列電離方程式判斷,下列分組正確的是( )
①H2SO4===2H++![]() 、②Ba(OH)2===Ba2++2OH-、③KAl(SO4)2===K++Al3++2
、②Ba(OH)2===Ba2++2OH-、③KAl(SO4)2===K++Al3++2![]() 、④NaHSO4===Na++H++
、④NaHSO4===Na++H++![]()
A. 屬于酸的是①④ B. 屬于堿的是②
C. 屬于鹽的只有③ D. 屬于鹽的只有④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碘及其化合物在生產、生活和科技等方面都有著重要的應用。回答下列問題:
(1)已知:①2I2(s)+5O2(g)=2I2O5(s) ΔH=—1966 kJmol-1
②2CO(g)+O2(g)=2CO2(g) ΔH=—1200 kJmol-1 。
則5CO(g)+I2O5(s)=5CO2(g)+I2(s)的△H= __________________________。
(2)碘不易溶于水,但易溶于碘化鉀溶液并生成多碘離子,反應如下:
① I2(s)+I-(aq)![]() I3-(aq) △H<0; ② I2 (s)+2I-(aq)
I3-(aq) △H<0; ② I2 (s)+2I-(aq)![]() I42-(aq)。
I42-(aq)。
溫度降低時,反應①的平衡常數將______________(填“增大”“減小”或“不變”);反應②的平衡常數的表達式為K=__________________________。
(3)碘與鎢在一定溫度下,可發生如下可逆反應:W(s)+I2(g)![]() WI2(g)。現準確稱取0.508g碘和0.736g金屬鎢放置于50.0mL的密閉容器中,并加熱使其反應。如圖是混合氣體中的WI2蒸氣的物質的量隨時間變化關系的圖象[n(WI2)~t],其中曲線Ⅰ(0~t2時間段)的反應溫度為450℃,曲線Ⅱ(從t2時刻開始)的反應溫度為530℃。
WI2(g)。現準確稱取0.508g碘和0.736g金屬鎢放置于50.0mL的密閉容器中,并加熱使其反應。如圖是混合氣體中的WI2蒸氣的物質的量隨時間變化關系的圖象[n(WI2)~t],其中曲線Ⅰ(0~t2時間段)的反應溫度為450℃,曲線Ⅱ(從t2時刻開始)的反應溫度為530℃。
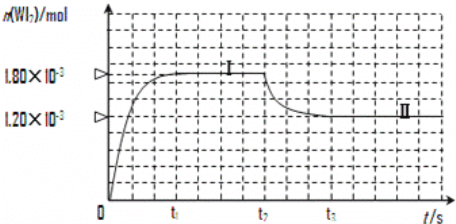
① 該反應△H____________0(填“>”或“<”)。
② 反應從開始到t1(t1= 3 min)時間內 I2 的平均反應速率v(I2)=_________。
③ 在450℃時,該反應的平衡常數K的值為__________________。
④ 能夠說明上述反應已經達到平衡狀態的有________________ (填選項字母)。
A.I2與WI2的濃度相等 B. 容器內各氣體的濃度不再改變
C. 容器內混合氣體的密度不再改變 D.容器內氣體壓強不發生變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知100 kPa、298.15 K時氫氟酸的電離過程HF(aq)H+(aq)+F-(aq) ΔH=-12.5kJ·mol-1,ΔS=-102.5 J·mol-1·K-1,試判斷該過程的自發性( )
A. 可自發進行 B. 不能自發進行 C. 達到平衡 D. 不能判定
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在恒容密閉容器中通入X并發生反應:2X(g)![]() Y(g),溫度T1、T2下X的物質的量濃度c(X)隨時間t變化的曲線如圖所示。下列敘述正確的是
Y(g),溫度T1、T2下X的物質的量濃度c(X)隨時間t變化的曲線如圖所示。下列敘述正確的是
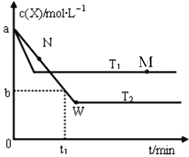
A. M點的 v正小于N點的v逆
B. M點時,升高溫度平衡逆向移動
C. T2下,在0-t1時間內,v(X)=![]() mol·L-1·min-1
mol·L-1·min-1
D. W點時再加入一定量Y,平衡后Y的體積分數減小
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com