
【題目】下列物質中,屬于鹽類的是
A.Na2OB.Ca(OH)2C.CaCO3D.H2SO4
科目:高中化學 來源: 題型:
【題目】工業(yè)上曾經(jīng)通過反應“3Fe + 4NaOH![]() Fe3O4+ 2H2↑+4Na↑” 生產金屬鈉。下列有關說法正確的是
Fe3O4+ 2H2↑+4Na↑” 生產金屬鈉。下列有關說法正確的是
A. 用磁鐵可以將Fe與Fe3O4分離 B. 將生成的氣體在空氣中冷卻可獲得鈉
C. 該反應條件下鐵的氧化性比鈉強 D. 每生成lmolH2,轉移的電子數(shù)約為4×6.02×1023
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現(xiàn)有某鐵碳合金(鐵和碳兩種單質的混合物),某化學興趣小組為了測定鐵碳合金中鐵的質量分數(shù),并探究濃硫酸的某些性質,設計了下圖所示的實驗裝置(夾持儀器已省略)和實驗方案進行實驗探究。
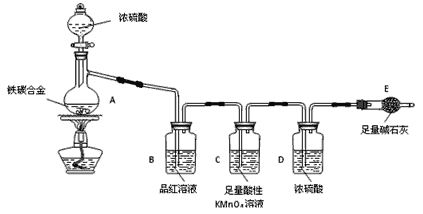
I.測定鐵的質量分數(shù):
(1)檢查上述裝置氣密性的一種方法是:關閉分液漏斗的活塞,在E裝置后面連上一根導管,然后___________________________________________________________________,則證明裝置的氣密性良好。
(2)稱量E的質量,并將a g鐵碳合金樣品放入裝置A中,再加入足量的濃硫酸,待A中不再逸出氣體時,停止加熱,拆下E并稱重,E增重b g。鐵碳合金中鐵的質量分數(shù)為______________________(寫表達式)。
(3)裝置C的作用______________________________________________。s5
(4)甲同學認為,依據(jù)此實驗測得的數(shù)據(jù),計算合金中鐵的質量分數(shù)可能會偏低,原因是空氣中CO2、水蒸氣進入E管使b增大。你認為改進的方法是________________________________________。
(5)乙同學認為,即使甲同學認為的偏差得到改進,依據(jù)此實驗測得合金中鐵的質量分數(shù)也可能會偏高。你認為其中的原因是________________________________________________________。
Ⅱ.探究濃硫酸的某些性質:
(6)往A中滴加足量的濃硫酸,未點燃酒精燈前,A、B均無明顯現(xiàn)象,其原因是:_______________________________________。
(7)A中鐵與濃硫酸發(fā)生反應的化學方程式是_______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是
A. 酸性氧化物和堿性氧化物都是電解質
B. 將NaOH溶液逐滴加入FeCl3溶液可制備Fe(OH)3膠體
C. 電化學腐蝕是造成金屬腐蝕的主要原因
D. 離子鍵一定只存在于離子化合物中,共價鍵一定只存在于共價化合物中
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA表示阿伏加德羅常數(shù)值,下列說法正確的是
A. 室溫下,21.0g 乙烯與丙烯的混合氣體中含有的碳原子數(shù)為1.5NA
B. 常溫常壓下,0.1molC8H18所含有的共價鍵數(shù)目為2.0 NA
C. 0.1mol乙醇與氧氣完全反應生成二氧化碳時轉移電子數(shù)為0.1NA
D. 標準狀況下,2.24L乙酸乙酯中所含氧原子數(shù)為0.2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于油脂的敘述錯誤的是
A. 油脂由C、H、O三種元素組成
B. 油脂在堿性條件下不能發(fā)生水解反應
C. 天然油脂的主要成份是高級脂肪酸甘油酯
D. 工業(yè)上可以用油脂制造肥皂等化工產品
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】通過海水晾曬可得粗鹽,粗鹽除NaCl外,還含有MgCl2、CaCl2、Na2SO4以及泥沙等雜質。以下是制備精鹽的實驗方案,各步操作流程如下:

(1)第②步操作的目的是除去粗鹽中的________________(填化學式,下同),第⑥步操作的目的是除去濾液中_______________________________。
(2)第⑤步“過濾”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、CaCO3、________(填化學式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫氣是一種新型的綠色能源,又是一種重要的化工原料。以生物材質 (以C 計)與水蒸氣反應制取H2是種低耗能,高效率的制H2方法。該方法由氣化爐制造H2和燃燒爐再生CaO兩步構成。氣化爐中涉及到的反應為:
I C(s)+H2O(g)![]() CO(g)+H2(g) K1;
CO(g)+H2(g) K1;
II CO(g)+H2O(g)![]() CO2(g)+H2(g) K2;
CO2(g)+H2(g) K2;
III CaO(s)+CO2(g)![]() CaCO3(s) K3;
CaCO3(s) K3;
燃燒爐中涉及到的反應為:
IV C(s)+O2(g)=CO2
V CaCO3(s)=CaO(s)+CO2(g)
(1)該工藝制H2總反應可表示為C(s)+2H2O(g)+CaO(s) ![]() CaCO3(s)+2H2(g),其反應的平衡常數(shù)K=__________(用K1、K2、K3的代數(shù)式表示)。在2L的密閉容器中加入一定量的C(s)、H2O(g)和CaO(s)。下列能說明反應達到平衡的是_______________________。
CaCO3(s)+2H2(g),其反應的平衡常數(shù)K=__________(用K1、K2、K3的代數(shù)式表示)。在2L的密閉容器中加入一定量的C(s)、H2O(g)和CaO(s)。下列能說明反應達到平衡的是_______________________。
A.容器內壓強不再變化 B. H2與H2O(g)的物質的量之比不再變化
C.混合氣體的密度不再變化 D.形成a molH-H鍵的同時斷裂2amolH-O鍵
(2)對于反應I,不同溫度和壓強對H2產率影響如下表。
溫度 | 壓強p1/Mpa | 壓強p2/Mpa |
500℃ | 45.6% | 51.3% |
700℃ | 67.8% | 71.6% |
下列圖像正確的是__________________。

(3)已知反應Ⅱ的ΔH=-41.1kJ/mol,C=O、O-H、H-H的鍵能分別為 803 kJ/mol,464 kJ/mol、436 kJ/mol,則CO中碳氧鍵的鍵能為___________ kJ/mol。
(4)對于反應Ⅲ,若平衡時再充入CO2,使其濃度增大到原來的2倍,則平衡移動方向為___________;當重新平衡后,CO2濃度___________(填“變大”“ 變小”“ 不變”)。
(5)甲醇燃料電池是采用鉑作電極催化劑,其工作原理的示意圖如下:

請回答下列問題:
①Pt(a)電極是電池的_______極,電極反應式為______________________;
②常溫下,用此電池以惰性電極電解0.5L飽和食鹽水(足量),若兩極共生成氣體1.12L(已折算為標準狀況下的體積),則電解后溶液的pH=_________(忽略溶液的體積變化)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏加德羅常數(shù)的值。下列敘述正確的是
A. 標準狀況下,11.2 L水中含有的分子數(shù)是0.5NA
B. 常溫常壓下,17g氨氣中所含原子數(shù)為NA
C. 1 mol OH- 中含有電子數(shù)為10NA
D. 1 mol/LBaCl2溶液中含有的氯離子數(shù)為2NA
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com