
【題目】短周期元素X、Y、Z、W在元素周期表中的相對位置如圖所示,其中W原子的質子數是其最外層電子數的三倍,下列說法錯誤的是( )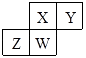
A.原子半徑:Z>W>X>Y
B.元素X、Y、Z、W的最高化合價分別與其主族序數相等
C.最簡單氣態氫化物的熱穩定性:Y>X>W>Z
D.最高價氧化物對應水化物的酸性:X>W>Z
【答案】B
【解析】短周期元素X、Y、Z、W在元素周期表中的相對位置如圖所示,結合元素周期表結構可知,X、Y應該位于第二周期、Z、W位于第三周期;W原子的質子數是其最外層電子數的三倍,設W的最外層電子數為x,則3x=2+8+x,解得:x=5,W為P元素,則Z為Si元素、X為N元素、Y為O元素,
A.X、Y含有兩個電子層,核電荷數Y大于X,則原子半徑X>Y;Z、W含有3個電子層,核電荷數W的解答,其原子半徑較小,則原子半徑大小為:Z>W>X>Y,故A不符合題意;
B.Y為氧元素,氧元素沒有最高正價,故B符合題意;
C.最簡單氣態氫化物的熱穩定性取決于非金屬性大小,非金屬性:Y>X>W>Z,則其最簡單氫化物穩定性大小為:Y>X>W>Z,故C不符合題意;
D.再根據氧化物對應水合物的酸性與非金屬性大小有關,非金屬性X>W>Z,則再根據含氧酸的酸性大小為:X>W>Z,故D不符合題意;
故答案為:B.
根據短周期元素X、Y、Z、W在元素周期表中的相對位置,結合元素周期表結構可知,判斷出X、Y應該位于第二周期、Z、W位于第三周期;W原子的質子數是其最外層電子數的三倍,設W的最外層電子數為x,則3x=2+8+x,解得:x=5,W為P元素,則Z為Si元素、X為N元素、Y為O元素,結合元素周期律知識解答即可.


科目:高中化學 來源: 題型:
【題目】下列敘述正確的是
A. 等質量的甲烷和乙烯完全燃燒,甲烷消耗的O2多
B. C5H11Cl有6種同分異構體
C. 聚乙烯與乙烯性質相似,可使溴水褪色
D. 正丁烷和異丁烷互為同系物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關化學鍵的敘述,正確的是( )
A.硫酸氫鈉溶于水既有離子鍵被破壞又有共價鍵被破壞
B.單質分子中均含共價鍵
C.HF與HBr相比,分子內共價鍵更強,所以HF沸點更高
D.由不同元素組成的多原子分子里,只存在極性鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中不正確的是( )
A.乙烯能與溴的四氯化碳溶液反應使溶液逐漸褪色
B.乙醛能與新制氫氧化銅反應產生磚紅色沉淀
C.糖類物質都能發生水解反應
D.在一定條件下,氨基酸之間能發生反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物F(C11H12O2)屬于芳香酯類物質,可由下列路線合成:
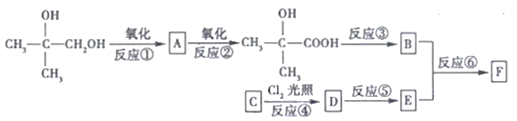
請回答下列問題:
(1)A中官能團的名稱是__________,上述③④⑤⑥中屬于取代反應的是_______________。
(2)C物質的名稱是_______,反應③的條件是________________________。
(3)B在一定條件下可以形成高分子化合物,寫出此過程的化學方程式:_________________。
(4)反應⑥的化學方程式為___________________________________。
(5)A、B、E三種有機物,可用下列的某一種試劑鑒別,該試劑是_______________________。
a.新制的Cu(OH)2懸濁液 b.溴水
c.酸性KMnO4溶液 d.溴的CC14溶液
(6)G是E的同系物且相對分子質量比E大28。G有多種同分異構體,其中符合下列條件的同分異構體有____種,其中核磁共振氫譜有5組峰,且面積比為6:1:2:2:1的結構簡式為_____________________。
①能與Na2CO3溶液反應 ②分子中含有兩個一CH3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據物質的溶解性“相似相溶”的一般規律,說明溴、碘單質在四氯化碳中比在水中溶解度大,下列說法正確的是( )
A. 溴、碘單質和四氯化碳中都含有鹵素
B. 溴、碘是單質,四氯化碳是化合物
C. Cl2、Br2、I2是非極性分子,CCl4也是非極性分子,而水是極性分子
D. 以上說法都不對
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用氮化硅(Si3N4)陶瓷代替金屬制造發動機的耐熱部件,能大幅度提高發動機的熱效率.工業上用化學氣相沉積法制備氮化硅,其反應如下:
3SiCl4(g)+2N2(g)+6H2(g)Si3N4(s)+12HCl(g)△H<0 完成下列填空:
(1)在一定溫度下進行上述反應,若反應容器的容積為2L,3min后達到平衡,測得固體的質量增加了2.80g,則H2的平均反應速率 mol(Lmin)﹣1;該反應的平衡常數表達式K= .
(2)上述反應達到平衡后,下列說法正確的是 .
a.其他條件不變,壓強增大,平衡常數K減小
b.其他條件不變,溫度升高,平衡常數K減小
c.其他條件不變,增大Si3N4物質的量,平衡向左移動
d.其他條件不變,增大HCl物質的量,平衡向左移動
(3)將0.050mol SO2(g)和0.030mol O2(g)放入容積為1L的密閉容器中,反應2SO2(g)+O2(g)2SO3(g)在一定條件下達到平衡,測得c(SO3)=0.040mol/L.計算該條件下反應的平衡常數K和SO2的平衡轉化率(寫出計算過程).
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com