
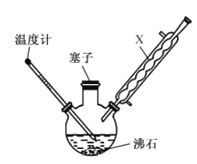
【題目】某同學在實驗室以苯胺(密度:1.02g.mL—1)和濃硫酸為原料制備對氨基苯磺酸(![]() ),反應原理以及反應裝置(加熱及夾持儀器已省略)如下:
),反應原理以及反應裝置(加熱及夾持儀器已省略)如下:
![]() +H2SO4(濃)
+H2SO4(濃)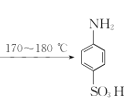 +H2O
+H2O
已知:100mL水在20C時可溶解對氨基苯磺酸1.08g,在100C時可溶解6.67g 。實驗步驟:
I.在100mL三頸燒瓶中加入10mL苯胺及幾粒沸石,將三頸燒瓶放入冷水中冷卻,小心地加入20mL濃硫酸;
II.將三頸燒瓶置于加熱裝置中緩慢加熱至170~180℃,維持此溫度2~2.5h;
III.將反應液冷卻至約50℃后,倒入盛有100mL冷水的燒杯中,用玻璃棒不斷攪拌,促使晶體析出,抽濾,用少量冷水洗滌,得到對氨基苯磺酸粗產品;
VI.將粗產品用沸水溶解,冷卻結晶,抽濾,收集產品,晾干得到16.2g對氨基苯磺酸。
回答下列問題:
(1)裝置中,x的名稱為______________ ,其作用是__________________ 。
(2)步驟II中,“加熱裝置”是 ________ (填“油浴”或“水浴”)裝置。
(3)步驟III中,需用少量冷水洗滌對氨基苯磺酸粗產品的原因是________________ 。
(4)步驟VI,冷卻結晶過程中,若溶液顏色過深,可用__________(填一種吸附劑)脫色。
(5)本實驗中對氨基苯磺酸的產率為__________(結果保留兩位小數)。
【答案】球形冷凝管 冷凝回流 油浴 冷水中對氨基苯磺酸的溶解度小 活性炭 85.38%
【解析】
以苯胺和濃硫酸發生取代反應得到對氨基苯磺酸,實驗中反應溫度高,對氨基苯磺酸容易揮發散失,需要冷凝管起到冷凝回流的作用,冷卻水應下進上出,反應溫度為170~180℃,因為水浴加熱的溫度受水的沸點限制,故選擇油浴加熱,從而得到產品,產品經過洗滌干燥處理即可,再根據![]() 可計算對氨基苯磺酸的產率。
可計算對氨基苯磺酸的產率。
(1)X為有冷凝回流作用的球形冷凝管,可減少對氨基苯磺酸的損失,故答案為:球形冷凝管;冷凝回流;
(2)由于反應溫度為170~180℃,而水浴加熱的溫度受水的沸點(100℃)限制,故選擇油浴加熱,故答案為:油浴;
(3)根據已知條件:100mL水在20C時可溶解對氨基苯磺酸1.08g,在100C時可溶解6.67g,則對氨基苯磺酸在冷水中的溶解度小,可減少對氨基苯磺酸溶解損失,故答案為:冷水中對氨基苯磺酸的溶解度小;
(4)活性炭可用于吸附色素,因此,在冷卻結晶過程中,若溶液顏色過深,可用活性炭進行脫色,故答案為:活性炭;
(5)根據![]() ,可得苯胺的質量
,可得苯胺的質量![]() ,根據方程式可知,n(對氨基苯磺酸)=n(苯胺),再根據
,根據方程式可知,n(對氨基苯磺酸)=n(苯胺),再根據![]() ,可得對氨基苯磺酸的理論產量
,可得對氨基苯磺酸的理論產量![]() ,氨基苯磺酸的實際產量為16.2g,則
,氨基苯磺酸的實際產量為16.2g,則![]() ,故答案為:85.38%。
,故答案為:85.38%。


 智能訓練練測考系列答案
智能訓練練測考系列答案科目:高中化學 來源: 題型:
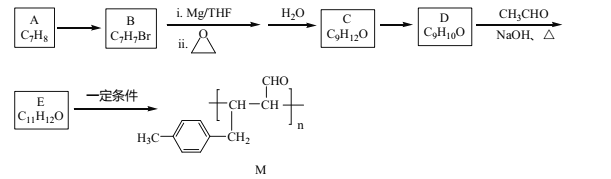
【題目】化合物M是一種有機高分子,其合成路線如下:
已知:①R-Br![]()
![]() R-CH2CH2OH
R-CH2CH2OH
②R-CHO![]() R-CH=CHCHO
R-CH=CHCHO
回答下列問題:
(1)A→B的反應試劑及條件是_______________。
(2)C→D的反應類型是_______________。
(3)化合物C的名稱是_____________。
(4)D與銀氨溶液反應的化學方程式為__________。
(5)E中官能團的名稱是_______。
(6)化合物X(C10H10O)是E的同系物,且苯環上只有兩個取代基,則X的同分異構體有______種,其中核磁共振氫譜為六組峰,峰面積之比為3:2:2:1:1:1的結構簡式為________。
(7)設計由CH3Cl、環氧乙烷和乙醛制備CH3CH2CH=CHCHO的合成路線________(其他試劑任選)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列氯代烴中不能由烯烴與氯化氫加成直接得到的有( )
A. 2一乙基—4—氯—1—丁烯 B. 氯代環己烷
C. 2,2,3,3—四甲基—1—氯丁烷 D. 3一甲基—3—氯戊烷
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于炔烴的說法中正確的是
A.分子中的碳原子不可能在同一直線上
B.分子中碳碳三鍵中的三個鍵的性質完全相同
C.分子組成符合CnH2n—2(n≥2)的鏈烴一定是炔烴
D.隨著碳原子數增加,分子中碳的質量分數逐漸降低
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】分子中含有三個以上-OCH2CH2O-重復單元的有機物叫冠醚,18-冠-6的結構簡式如圖所示:

下列說法正確的是( )
A.18-冠-6中的“18”指分子含有18個碳原子,“6”指分子含有6個氧原子
B.該分子中所有原子可能共平面
C.該分子的一氯代物只有1種
D.該有機物的最簡式和葡萄糖的相同
查看答案和解析>>
科目:高中化學 來源: 題型:
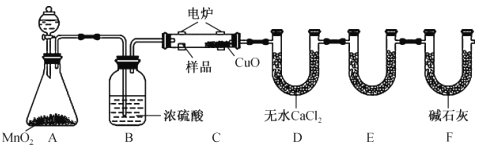
【題目】利用下圖所示裝置可確定有機物的化學式,其原理:在玻璃管內,用純氧氧化管內樣品,根據產物的質量確定有機物的組成。
回答下列問題:
(1)裝置B中的作用是____________________;若無B裝置,則會造成測得的有機物中含氫量_________(填“偏大”“偏小”或“不變”)。
(2)裝置E中所盛放的試劑是________ ,其作用為______________ 。
(3)若準確稱取1.20g有機物(只含C、H、O 三種元素中的兩種或三種),經充分燃燒后,E管質量增加1.76g,D管質量增加0.72g,則該有機物的最簡式為_______________。
(4)要確定該有機物的分子式,還需要測定_________________ 。
(5)若該有機物的相對分子質量為60,核磁共振氫譜中有2組峰且面積比為3:1,則該有機物可能為乙酸或________ (填名稱),可采取_______ 方法(填一種儀器分析法)確定該有機物具體是何種物質。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】錫酸鈉(Na2SnO3)主要用作電鍍銅錫合金和堿性鍍錫的基本原料。錫精礦除含SnO2外,還含有少量WO3、S、As、Fe,一種由錫精礦制備錫酸鈉的工藝流程如圖:
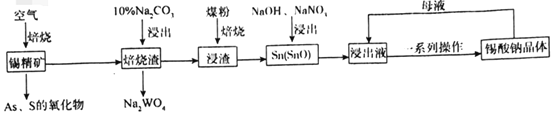
已知:①焙燒后,S、As變為揮發性氧化物而被除去,Fe變為Fe3O4;
②錫酸鈉易溶于水,其溶解度隨著溫度的升高而降低。
請回答下列問題:
(1)Na2SnO3中錫元素的化合價為___,從焙燒渣中除去Fe3O4最簡單的方法為___。
(2)WO3與Na2CO3溶液反應生成Na2WO4的化學方程式為___。
(3)加入煤粉焙燒可將SnO2還原為Sn或SnO,Sn或SnO在堿性條件下均能被NaNO3氧化為Na2SnO3,已知NaNO3的還原產物為NH3,則NaNO3氧化Sn的化學方程式為___。
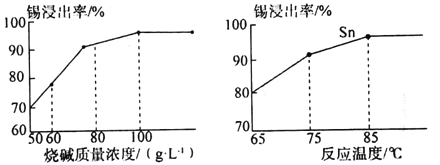
(4)如圖為加入NaOH溶液和NaNO3溶液浸出時錫的浸出率與NaOH的質量濃度和反應時間的關系圖,則“堿浸”時最適宜條件為___、___。
(5)從浸出液中獲得錫酸鈉晶體的“一系列操作”具體是指___,將母液返回至浸出液的目的為___。
(6)堿性鍍錫以NaOH和Na2SnO3為電解液,以純錫為陽極材料,待鍍金屬為陰極材料,鍍錫時陽極反應的電極反應式為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2018年,美國退出了《巴黎協定》實行再工業化戰略,而中國卻加大了環保力度,生動詮釋了我國負責任的大國形象。近年我國大力加強溫室氣體CO2催化氫化合成甲醇技術的工業化量產研究,實現可持續發展。
(1)已知:I.CO2(g)+H2(g)![]() H2O(g)+CO(g) △H1=+41.1kJ/mol
H2O(g)+CO(g) △H1=+41.1kJ/mol
II.CO(g)+2H2(g)![]() CH3OH(g) △H2=-90.0kJ/mol
CH3OH(g) △H2=-90.0kJ/mol
寫出CO2催化氫化合成甲醇的熱化學方程式:________。
(2)為提高CH3OH的產率,理論上應采用的條件是________(填選項字母)。
a.高溫高壓 b.低溫低壓 c.高溫低壓 d.低溫高壓
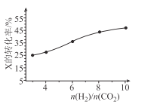
(3)250℃時,在恒容密閉容器中由CO2(g)催化氫化合成 CH3OH(g),不同投料比[n(H2)/n(CO2)]時某反應物X的平衡轉化率變化曲線如圖所示。反應物X是_______(填“CO2”或“H2”),判斷依據是_______。
(4)250℃時,在體積為2.0 L的恒容密閉容器中加入6mol H2、2mol CO2和催化劑發生 CO2催化氫化合成甲醇的反應,10 min時反應達到平衡,測得c(CH3OH) = 0.75 mol L-1。
①前10 min內的平均反應速率H2=_______ mol L-1 min-1。
②該溫度下,該反應的化學平衡常數K =_______。
③催化劑和反應條件與反應物轉化率和產物的選擇性高度相關。控制相同投料比和相同反應時間,四組實驗數據如下表所示:
實驗編號 | 溫度(K) | 催化劑 | CO2轉化率(%) | 甲醇選擇性(%) |
A | 543 | Cu/ZnO納米棒 | 12.3 | 42.3 |
B | 543 | Cu/ZnO納米片 | 11.9 | 72.7 |
C | 553 | Cu/ZnO納米棒 | 15.3 | 39.1 |
D | 553 | Cu/ZnO納米片 | 12.0 | 70.6 |
根據上表所給數據,用CO2生產甲醇的最優選項為________(填字母)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯乙烯是一種重要的有機化工原料,某化學小組利用如圖裝置制備氯乙烯,下列有關說法錯誤的是
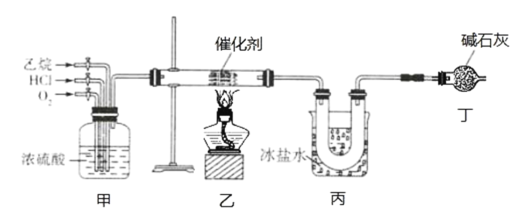
A.裝置乙中發生反應的化學方程式為:CH3CH3+HCl+O2![]() CH2=CHCl+2H2O
CH2=CHCl+2H2O
B.裝置甲可通過控制通入氣體的速率來控制反應氣體的物質的量之比
C.裝置丙的主要作用為冷凝并分離出氯乙烯
D.裝置丁可以完全吸收尾氣,實現尾氣零排放
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com