
【題目】現有a mol/L 的NaX和b mol/L的NaY兩種鹽溶液。下列說法正確的是
A.若a=b且c(X-)= c(Y-)+ c(HY),則HX為強酸
B.若a=b且pH(NaX)>pH(NaY),則c(X-)+ c(OH-)> c(Y-)+ c(OH-)
C.若a>b且c(X-)= c(Y-),則酸性HX>HY
D.若兩溶液等體積混合,則c(Na+)=(a+b) mol/L(忽略混合過程中的體積變化)
【答案】A
【解析】
試題分析:A.若a=b,且c(X-)=c(Y-)+c(HY),說明HX完全電離,所以能說明HX為強酸,故A 正確;B.若a=b且pH(NaX)>pH(NaY),根據電荷守恒得c(Na+)+c(H+)=c(X-)+c(OH-),c(Na+)+c(H+)=c(Y-)+c(OH-),根據物料守恒得兩種溶液中c(Na+)相等,根據溶液的PH知,X-的水解程度大于Y-,所以NaX中氫離子濃度小于NaY,所以c(X-)+c(OH-)<c(Y-)+c(OH-),故B錯誤;C.若a>b且c(X-)=c(Y-),說明X- 的水解程度大于Y-,酸根離子水解程度越大,其相應酸的酸性越弱,則酸性HX<HY,故C錯誤;D.若兩溶液等體積混合,鈉離子不水解,但溶液體積增大一倍,所以則c(Na+)=![]() mol/L,故D錯誤;故選A。
mol/L,故D錯誤;故選A。


科目:高中化學 來源: 題型:
【題目】I.下列七種有機物中:①CH4 ②CH2=CH2 ③![]() ④CH3COOH ⑤HOCH2CHO ⑥CH3CH2CH2CH3 ⑦葡萄糖 ⑧蛋白質 ⑨淀粉
④CH3COOH ⑤HOCH2CHO ⑥CH3CH2CH2CH3 ⑦葡萄糖 ⑧蛋白質 ⑨淀粉
(1)可與濃硝酸發生顏色反應的是______________(填序號,下同)。
(2)屬于同系物的是__________
(3)互為同分異構體的是___________。.
(4)易發生銀鏡反應的是______________
II.在5L的密閉容器中充入1mol A 和2mol B,在一定條件下發生反應4A(g)+5B(g)![]() 4C(g)+6D(g),半分鐘后,C的物質的量增加了0.30mol.
4C(g)+6D(g),半分鐘后,C的物質的量增加了0.30mol.
(5)D的平均反應速率為 .
(6)A的轉化率為
(7) 不能判斷該反應已達平衡狀態的是
A 單位時間內生成n mol A的同時生成2n mol D的狀態
B 生成物濃度不再變化的狀態 .
C 混合氣體的平均相對分子質量不再改變的狀態.
D 混合氣體的壓強不再改變的狀態
E 容器中各組分的體積分數不隨時間變化的狀態
F 容器中A、B、C、D的物質的量的比一定是4:5:4:6的狀態
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種三室微生物燃料電池污水凈化系統原理如右圖所示。圖中有機廢水中有機物可用C6H10O5表示。下列有關說法正確的是
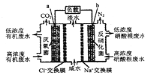
A.b電極為該電池的負極
B.b電極附近溶液的pH減小
C.a電極反應式:C6H10O5-24e-+7H2O═6CO2↑+24H+
D.中間室:Na+移向左室,Cl-移向右室
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E、F六種元素的原子序數依次遞增。已知:
①F的原子序數為29,其余均為短周期主族元素;
②A的內層電子總數是最外層電子數的一半;
③C、E同主族且C原子最外層電子數是次外層電子數的3倍;
④D是金屬性最強的短周期元素。完成下列問題
(1)F在元素周期表的位置______________。
(2)B、C、D、E的原子半徑由小到大順序是_________ (用元素符號表示)。
(3)已知D在C的單質中燃燒生成淡黃色的固體化合物甲,甲的化學式為_______________,電子式為_______,甲中的化學鍵類型為____________________。
(4)A的單質與E的最高價含氧酸反應的化學方程式 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將4 mol A氣體和2 mol B氣體在2 L固定體積的容器中混合,并在一定條件下發生如下反應∶2A(g)+B(g)![]() 2C(g)。若經2s后測得C的濃度為0.6 molL-1,
2C(g)。若經2s后測得C的濃度為0.6 molL-1,
求(1)A表示的反應的平均速率?
(2)2 s時物質B的濃度?
(3)2 s時物質A的轉化率?
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】t℃時Ag2CrO4在水中的沉淀溶解平衡曲線如圖所示。下列說法正確的是( )
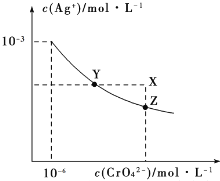
A.加熱蒸發飽和Ag2CrO4溶液再恢復到t℃,可使溶液由Y點變到Z點
B.在X點沒有Ag2CrO4沉淀生成,則此時溫度低于t℃
C.向飽和Ag2CrO4溶液中加入少量AgNO3固體,可使溶液由Z點到Y點
D.在t℃時,Ag2CrO4的Ksp為1×10-9
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】若乙酸分子中的氧都是18O,乙醇分子中的氧都是16O,二者在濃H2SO4作用下發生酯化反應,一段時間后,分子中含有18O的物質有
A.1種 B.2種 C.3種 D.4種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】
步驟 | 實驗過程 | 實驗用品 |
I | 將干海帶灼燒灰化 |
|
II | 將海帶灰溶解、過濾 |
|
III | 氧化濾液中的I-,反應的離子方程式為 ② |
|
IV | 取少量III中反應后溶液于試管中,加入少量CCl4并振蕩后靜置,觀察到 ③ ,說明海帶中含有碘元素 |
|
(2)利用新制氨水、1mol/L NaBr溶液、淀粉液、以及II中所得溶液,驗證鹵素單質氧化性的相對強弱。
V分別取5mL 1mol/L NaBr溶液于兩支小試管中
VI向兩支試管中分別滴加5滴新制氯水,溶液均變為黃色
VII向其中一支試管中繼續滴加新制氯水,直至溶液變為棕紅色
VIII……
④請寫出步驟VI中反應的離子方程式 ;為驗證溴的氧化性強于碘,步驟VIII的操作和現象是: ,溶液變為黃色。再加入 ,溶液變為藍色。
⑤步驟VII的目的是 。
⑥氯、溴、碘單質的氧化性逐漸減弱的原因:同主族元素從上到下, ,得電子能力逐漸減弱,非金屬性減弱。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com