
【題目】貝殼、珍珠、方解石等主要成分均含有CaCO3,回答下列問題:
(1)利用焰色反應的原理既可制作五彩繽紛的節(jié)日煙花,亦可定性鑒別某些金屬鹽。灼燒碳酸鈣時的焰色為_______(填標號)。
A 黃色 B 紅色 C 紫色 D 綠色
(2)CaCO3中三種元素第一電離能由小到大的順序是__________。CaCO3中的化學鍵除了σ鍵外,還存在_________________。
(3)關于CO2和CO32-的下列說法正確的是__________。
a 兩種微粒價層電子對數相同 b 兩種微粒的中心原子均無孤電子對
c 鍵角:CO2>CO32- d 兩種微粒的中心原子雜化方式相同
(4)難溶碳酸鹽易分解,CaCO3、BaCO3熱分解溫度更高的是_____,原因是______。
(5)方解石的菱面體結構如圖1,沿三次軸的俯視圖為正六邊形。方解石的六方晶胞結構如圖2,晶胞底面為平行四邊形,其較小夾角為60°,邊長為anm,晶胞高為c nm。
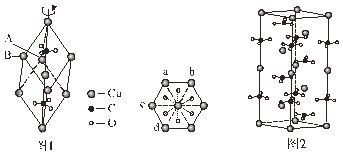
A點在俯視圖中為a,則B點在俯視圖中的位置為_________(填字母)。方解石的六方晶胞中,Ca2+和CO32-個數比為___________;若阿伏加德羅常數為NA,則該方解石的密度為________g/cm3(列出計算式)。
【答案】B Ca<C<O π鍵、離子鍵 b c BaCO3 Ca2+半徑比Ba2+小,對CO32-中的O2-吸引力更大,且產物CaO比BaO更穩(wěn)定 d 1:1 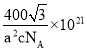
【解析】
(1)鈣的焰色反應為紅色;
(2)通常金屬元素第一電離能較小,同周期元素從左到右第一電離能增強;CaCO3中的化學鍵除了σ鍵,還有一個四原子六電子的π鍵和離子鍵;
(3) CO2中C原子是中心原子,屬于IVA族,最外層電子數時4。最外層電子數減去兩個O原子成鍵時所需要的電子數,即4-2×2=0,所以C原子并沒有孤對電子,CO2中要C原子與兩個O結合形成2個σ鍵,所以C原子的價層電子對數為0+2=2;中心C原子是sp雜化,分子構型為直線型,鍵角180°,CO32-中C原子是中心原子,中心原子是sp2雜化,平面型結構,鍵角是120°,價層電子對數是0+3=3,離子中存在3個σ鍵,孤電子對為0個;
(4)碳酸鹽在熱分解過程中,當金屬陽離子所帶電荷數相同時,陽離子半徑越大,其結合碳酸根里氧離子的能力就弱,對應的碳酸鹽就越難分解,所需熱分解溫度就越高;
(5)根據AB兩點的空間位置分析B點在俯視圖中的位置,根據圖示求出晶胞中的粒子數目,先求底面積,再根據密度等于質量除以體積進行計算。
根據以上分析解答此題。
(1) )鈣元素的焰色反應為紅色。
答案為:B。
(2) 通常金屬元素第一電離能較小,同周期元素從左到右第一電離能增強,所以CaCO3中三種元素第一電離能由小到大的順序是Ca<C<O,CaCO3中的化學鍵除了σ鍵,還有一個四原子六電子的π鍵和離子鍵。
答案為:Ca<C<O;π鍵、離子鍵。
(3) CO2中C原子是中心原子,屬于IVA族,最外層電子數時4。最外層電子數減去兩個O原子成鍵時所需要的電子數,即4-2×2=0,所以C原子并沒有孤對電子,CO2中要C原子與兩個O結合形成2個σ鍵,所以C原子的價層電子對數為0+2=2;中心C原子是sp雜化,分子構型為直線型,鍵角180°,CO32-中C原子是中心原子,中心原子是sp2雜化,平面型結構,鍵角是120°,價層電子對數是0+3=3,離子中存在3個σ鍵,孤電子對為0個。
a.CO2和CO32-價層電子對數分別為2、3,a錯誤;
b.CO2和CO32-的中心原子都是C原子,均無孤電子對,b正確;
c.CO2中鍵角180°,CO32-中鍵角是120°,鍵角:CO2>CO32-,c正確;
d.CO2的中心C原子是sp雜化,CO32-的中心原子是sp2雜化,雜化方式不同,d錯誤;
答案為b c。
(4) 碳酸鹽在熱分解過程中,晶體里的金屬陽離子與CO32-中的氧離子結合,使CO32-分解為CO2。當金屬陽離子所帶電荷數相同時,陽離子半徑越大,其結合CO32-中的氧離子的能力就越弱,對應的碳酸鹽就越難分解,所需熱分解溫度就越高,生成的氧化物就越不穩(wěn)定。所以CaCO3、BaCO3熱分解溫度更高的是BaCO3,原因是Ca2+半徑比Ba2+小,對CO32-中的O2-吸引力更大,且產物CaO比BaO更穩(wěn)定。
答案為:BaCO3;Ca2+半徑比Ba2+小,對CO32-中的O2-吸引力更大,且產物CaO比BaO更穩(wěn)定。
(5) 由圖1可知A點與B點為平行四邊形的對角線位置,所以A點在俯視圖中為a,則B點在俯視圖中的位置為d;根據圖2晶胞結構圖計算:Ca2+個數為8![]() +4
+4![]() +4=6,CO32-個數為8
+4=6,CO32-個數為8![]() +4=6,方解石的六方晶胞中,Ca2+和CO32-個數比為6:6=1:1;晶胞的底面為平行四邊形,據題中條件底面積表示為asin60°a=
+4=6,方解石的六方晶胞中,Ca2+和CO32-個數比為6:6=1:1;晶胞的底面為平行四邊形,據題中條件底面積表示為asin60°a=![]() a210
a210![]() ,晶胞密度為
,晶胞密度為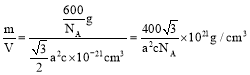 。
。
答案為:d;1:1;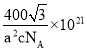 。
。


科目:高中化學 來源: 題型:
【題目】通過以下反應可獲得新型能源二甲醚(![]() )。下列說法不正確的是
)。下列說法不正確的是
①![]()
![]()
②![]()
![]()
③![]()
![]()
④![]()
![]()
A. 反應①、②為反應③提供原料氣
B. 反應③也是![]() 資源化利用的方法之一
資源化利用的方法之一
C. 反應![]() 的
的![]()
D. 反應![]() 的
的![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物A(C11H8O4)在氫氧化鈉溶液中加熱反應后再酸化可得到化合物B和C.回答下列問題:
(1)B的分子式為C2H4O2,分子中只有一個官能團.則B的結構簡式是 ,B與乙醇在濃硫酸催化下加熱反應生成D,該反應的化學方程式是 ,該反應的類型是 ;寫出兩種能發(fā)生銀鏡反應的B的同分異構體的結構簡式 .
(2)C是芳香化合物,相對分子質量為180,其碳的質量分數為60.0%,氫的質量分數為4.4%,其余為氧,則C的分子式是 .
(3)已知C的芳環(huán)上有三個取代基,其中一個取代基無支鏈,且還有能使溴的四氯化碳溶液褪色的官能團及能與碳酸氫鈉溶液反應放出氣體的官能團,則該取代基上的官能團名稱是 .另外兩個取代基相同,分別位于該取代基的鄰位和對位,則C的結構簡式是 .
(4)A的結構簡式是 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氟離子電池是新型電池中的一匹黑馬,其理論比能量高于鋰電池。一種氟離子電池的工作原理如圖所示。下列說法正確的是
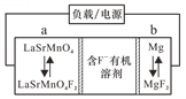
A.放電時,b是電源的正極
B.放電時,a極的電極反應為:LaSrMnO4F2+2e-=LaSrMnO4+2F-
C.充電時,電極a接外電源的負極
D.可將含F-的有機溶液換成水溶液以增強導電性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在探究檸檬電池的工作原理時,某課外小組同學發(fā)現:當按圖Ⅰ所示連接一個檸檬時,二極管不發(fā)光;按圖Ⅱ所示連接幾個檸檬時,二極管發(fā)光。下列說法不正確的是

A. 圖Ⅰ中二極管不發(fā)光,說明該裝置不構成原電池
B. 圖Ⅱ中鐵環(huán)為負極、銅線為正極,負極的電極反應為:Fe-2 e-===Fe2+
C. 圖Ⅰ中二極管不發(fā)光的原因是單個檸檬電池的電壓較小
D. 圖Ⅱ中所得的電池組的總電壓是各個檸檬電池的電壓之和
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】羅氟司特是治療慢性阻塞性肺病的特效藥物,其合成中間體F的一種合成路線如下:
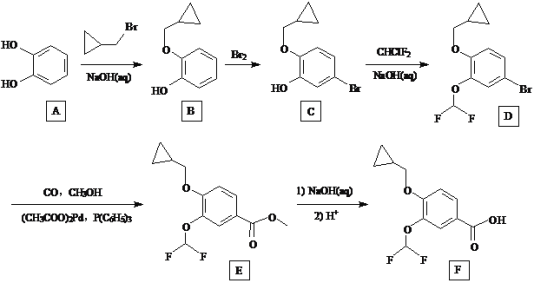
回答下列問題:
(1)A的化學名稱為__________,D的分子式為__________
(2)由B生成C的化學方程式是____________。
(3)E→F的反應類型為___________,F中含氧官能團的名稱為____________。
(4)上述合成路線中,有3步反應都使用NaOH溶液來提高產率,其原理是_______。
(5)![]() 的鏈狀同分異構體有_______種(不包括立體異構),寫出其中核磁共振氫譜有兩組峰的結構簡式:__________。
的鏈狀同分異構體有_______種(不包括立體異構),寫出其中核磁共振氫譜有兩組峰的結構簡式:__________。
(6)設計以對甲基苯酚為原料制備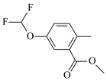 的合成路線:______(其他試劑任選)。
的合成路線:______(其他試劑任選)。
查看答案和解析>>
科目:高中化學 來源: 題型:
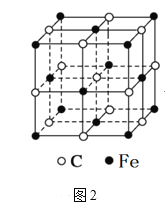
【題目】鐵和鈷是重要的過渡元素。
(1)鈷位于元素周期表中第___族,基態(tài)鈷原子中未成對電子的個數為_____。
(2)[Fe(H2NCONH2)6](NO3)3的名稱是三硝酸六尿素合鐵(Ⅲ),是一種重要的配合物。該化合物中中心離子Fe3+的核外價電子排布式為___;尿素分子中氮原子的雜化方式是___,尿素中所含非金屬元素的電負性由大到小的順序是___。
(3)Co(NH3)5BrSO4可形成兩種結構的鈷的配合物,已知Co3+的配位數是6,為確定鈷的配合物的結構,現對兩種配合物進行如下實驗:
在第一種配合物溶液中加硝酸銀溶液產生白色沉淀。
在第二種配合物溶液中加入硝酸銀溶液產生淡黃色沉淀,則第二種配合物的配體為_____。
(4)離子化合物CaC2的一種晶體結構如圖1所示,從鈣離子看,屬于____堆積,其配位數是_____;一個晶胞中平均含有的π鍵的個數為_____。
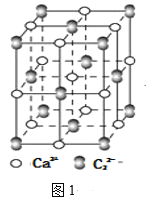
(5)科學研究結果表明。碳的氧化物CO2能夠與H2O借助于太陽能制備HCOOH,其反應原理如下:2CO2+2H2O=2HCOOH+O2,則生成的HCOOH分子中σ鍵和π鍵的個數比是____。
(6)奧氏體是碳溶解在γ-Fe中形成的一種間隙固溶體,無磁性,其晶胞如圖2所示,則該物質的化學式為______,若晶體密度為ρg/cm3,則晶胞中最近的兩個碳原子的距離為_____pm(阿伏加德羅常數的值用NA表示,寫出計算式即可)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】草酸(![]() )廣泛存在于食品中,人們對其及相關產品進行了深入研究。
)廣泛存在于食品中,人們對其及相關產品進行了深入研究。
(1) ![]() (s)═
(s)═ ![]() O(g)+CO(g)+C
O(g)+CO(g)+C![]() (g)△H=+340kJmo
(g)△H=+340kJmo![]() 在密閉容器中反應,保持溫度不變,下列有關選項正確的是_____(填序號)
在密閉容器中反應,保持溫度不變,下列有關選項正確的是_____(填序號)
A 恒容時,容器的壓強不再變化,說明該反應已達到化學平衡狀態(tài)
B 恒壓時,容器的體積不再變化,說明該反應已達到化學平衡狀態(tài)
C 氣體摩爾體積不再發(fā)生變化,說明該反應已達到化學平衡狀態(tài)
D 氣體平均摩爾質量不再發(fā)生變化,說明該反應已達到化學平衡狀態(tài)
E 氣體總質量不再發(fā)生變化,說明該反應已達到化學平衡狀態(tài)
(2)草酸分解所需燃料可以是CO,通過甲烷制備CO:C![]() (g)+C
(g)+C![]() (g)→2CO(g)+2
(g)→2CO(g)+2![]() (g)△H>O.常溫下,在2L的密閉容器中通入4molC
(g)△H>O.常溫下,在2L的密閉容器中通入4molC![]() 氣體和6molC
氣體和6molC![]() 氣體發(fā)生反應,5min后達到平衡,測得CO氣體的濃度為0.1mol
氣體發(fā)生反應,5min后達到平衡,測得CO氣體的濃度為0.1mol![]() 。
。
①平衡時,該反應的平均反應速率v(C![]() )=_____mol
)=_____mol![]() mi
mi![]() 。
。
②在不改變反應混合物用量的前提下,為了提高C![]() 氣體的轉化率,可采取的措施是_____。(答出一方面即可)
氣體的轉化率,可采取的措施是_____。(答出一方面即可)
(3)草酸(![]() )是二元弱酸,KH
)是二元弱酸,KH![]() 溶液呈酸性。向10mL 0.01mol
溶液呈酸性。向10mL 0.01mol![]() 的
的![]() 溶液滴加0.01mol
溶液滴加0.01mol![]() KOH溶液V(mL),回答下列問題。
KOH溶液V(mL),回答下列問題。
①當V=10mL時,溶液中H![]() 、
、![]() 、
、![]() 、
、![]() 的濃度從大到小的順序為_____。
的濃度從大到小的順序為_____。
② 當V=a mL時,溶液中離子濃度有如下關系:c(![]() )=2c(
)=2c(![]() )+c(H
)+c(H![]() );當V=b mL時,溶液中離子濃度有如下關系:c(
);當V=b mL時,溶液中離子濃度有如下關系:c(![]() )=c(
)=c(![]() )+c(H
)+c(H![]() )+c(
)+c(![]() );則a_____b(填“<”,“=”或“>”)。
);則a_____b(填“<”,“=”或“>”)。
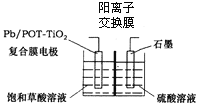
(4)電解飽和草酸溶液可以制得高檔香料乙醛酸(![]() ),裝置如圖所示,寫出復合膜電極的電極反應式_____。
),裝置如圖所示,寫出復合膜電極的電極反應式_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國科研人員研究了在 Cu-ZnO-ZrO2 催化劑上CO2加氫制甲醇過程中水的作用機理,其主反應歷程如圖所示(H2→*H+*H,帶*標記的物質是該反應歷程中的中間產物或過渡態(tài))。下列說法錯誤的是
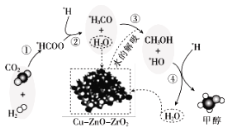
A.第①步中CO2和H2分子中都有化學鍵斷裂
B.水在整個歷程中可以循環(huán)使用,整個過程不消耗水也不產生水
C.第③步的反應式為:*H3CO+H2O→CH3OH+*HO
D.第④步反應是一個放熱過程
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com