
【題目】為維持人體內電解質平衡,人在大量出汗后應及時補充的離子是 ( )
A.Mg2+
B.Ca2+
C.Na+
D.Fe3+
科目:高中化學 來源: 題型:
【題目】Ⅰ.已知:CO2(g)+ 3H2(g) ![]() CH3OH(g)+ H2O(g) △H
CH3OH(g)+ H2O(g) △H
現在體積為1L的密閉容器中,充入CO2和H2。實驗測得反應體系中物質的物質的量與時間關系如下表,
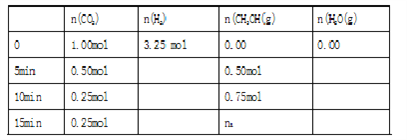
回答下列問題:
(1)表格中的n1=______________
(2)0-5min內 v (H2)=_______________
(3)該條件下CO2的平衡轉化率為__________________
Ⅱ.在容積為100L的密閉容器中,加入1.0molCH4和2.0molH2O(g)。一定條件下發生反應:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H
CO(g)+3H2(g) △H
已知CH4的轉化率與溫度、壓強的關系如圖1所示。回答下列問題:
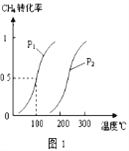
(4)100℃時平衡常數為_________________.
(5)圖1中的p1_______p2(填“<”、“>”或“=”),其理由是:_________________
(6)若100℃時該可逆反應的平衡常數是K1,200℃該該可逆反應的平衡常數是K2,則K1___ K2(填“<”、“>”或“=”).其理由是__________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏加德羅常數的值。下列說法正確的是
A. 2.24 L CH4中含碳原子數目是0.1 NA
B. 0.1 mol·L-1 NaNO3溶液中含Na+數目是0.1 NA
C. 1 mol Cl2與足量的鐵完全反應時得到的電子數目是2 NA
D. 標準狀況下,22.4 L苯中含分子數目是NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】分人類活動產生的CO2長期積累,威脅到生態環境,其減排問題受到全世界關注。
(1)工業上常用高濃度的K2CO3溶液吸收CO2,得溶液X,再利用電解法使K2CO3溶液再生,其裝置示意圖如下:

在陽極區發生的反應包括 和H ++ HCO3-= H2O + CO2↑。
簡述CO32-在陰極區再生的原理 。
(2)再生裝置中產生的CO2和H2在一定條件下反應生成甲醇等產物,工業上利用該反應合成甲醇。
已知:25 ℃,101 KPa下: H2(g) + 1/2 O2(g) ="==" H2O(g) ΔH1=" -242" kJ/mol
CH3OH(g) + 3/2 O2(g) ="==" CO2(g) + 2 H2O(g) ΔH2=" -676" kJ/mol
① 寫出CO2和H2生成氣態甲醇等產物的熱化學方程式 。
② 下面表示合成甲醇的反應的能量變化示意圖,其中正確的是 (填字母序號)。

(3)在密閉的再生裝置中,加入5 mol H2與2 mol CO2發生反應生成甲醇,反應達到平衡時,改變溫度(T)和壓強(P),反應混合物中甲醇(CH3OH)的物質的量分數變化情況如下圖所示,下列說法正確的是

A.P1> P2> P3>P4 |
B.甲醇的物質的量分數越高,反應的平衡常數越大 |
C.圖示中,該反應的溫度變化為:T1> T2> T3>T4 |
D.T4、P4、時,H2的平衡轉化率為60% |
(4)已知某種甲醇燃料電池中,電解質溶液為酸性,示意圖如下:

工作結束后,B電極室溶液的pH與工作前相比將 (填寫“增大”、“減小”或“不變”,溶液體積變化忽略不計)。A電極附近甲醇發生的電極反應式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,將Cl2通入NaOH溶液中,反應得到NaCl、NaClO、NaClO3的混合液,經測定ClO-與ClO3- 的濃度之比為1∶1,則Cl2與NaOH溶液反應時被還原的氯元素與被氧化的氯元素的物質的量之比為
A.4∶1 B.11∶3 C.3∶1 D.21∶5
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學是建立在實驗基礎上的學科。關于下列各實驗裝置的敘述中,不正確的是

A. 裝置①可用于實驗室制取少量 NH3 或 O2
B. 可用從 a 處加水的方法檢驗裝置②的氣密性
C. 實驗室可用裝置③收集 H2、NH3
D. 利用裝置④制硫酸和氫氧化鈉,其中 b 為陽離子交換膜、c 為陰離子交換膜
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各數值表示有關元素的原子序數,其所表示的各原子組中能以離子鍵相互結合成穩定化合物的是( )
A.10與12
B.8與17
C.19與17
D.6與14
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com