
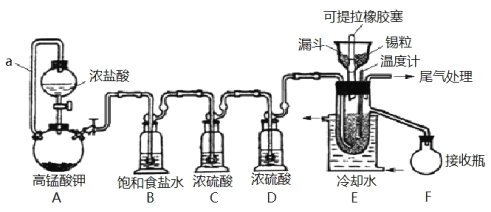
【題目】實驗室可用溢流法連續制備無水四氯化錫(SnCl4)。SnCl4易揮發,極易發生水解,Cl2極易溶于SnCl4。制備原理與實驗裝置圖如圖:
Sn(s)+2Cl2(g)=SnCl4(l) ΔH=–511kJmol-1
可能用到的有關數據如下:
物質 | Sn | SnCl4 | CuCl2 |
熔點/℃ | 232 | -33 | 620 |
沸點/℃ | 2260 | 114 | 993 |
制備過程中,錫粒逐漸被消耗,需提拉橡膠塞及時向反應器中補加錫粒。當SnCl4液面升至側口高度時,液態產物經側管流入接收瓶。回答下列問題:
(1)a的作用是___。
(2)A中反應的化學方程式是___。
(3)B的作用是___。
(4)E中冷卻水的作用是___。
(5)尾氣處理時,可選用的裝置是___(填序號)。
(6)錫粒中含銅雜質致 E 中產生 CuCl2,但不影響 F 中產品的純度,原因是___。
(7)SnCl4粗品中含有Cl2,精制時加入少許錫屑后蒸餾可得純凈的SnCl4。蒸餾過程中不需要用到的儀器有___(填序號)
A.分液漏斗 B.溫度計 C.吸濾瓶 D.冷凝管 E.蒸餾燒瓶
【答案】平衡壓強,使濃鹽酸順利流下 2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O 除去氯氣中混有的氯化氫氣體 避免四氯化錫氣化而損失,導致產率下降 乙 CuCl2熔點較高,不會隨四氯化錫液體溢出 A、C
【解析】
SnCl4極易水解,反應應在無水環境下進行進行,裝置A:采用KMnO4和濃鹽酸反應的方法制取Cl2,反應還生成MnCl2,發生2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O,制取的氯氣中含有氯化氫,通過飽和的氯化鈉溶液洗去氯氣中的氯化氫,SnCl4在空氣中極易水解,利用濃硫酸的吸水性干燥氯氣,防止產生SnCl4水解;然后Cl2和錫的反應,制備SnCl4,冷水冷卻,可將氣態的SnCl4冷凝回流收集產物;反應時應先生成氯氣,將氧氣排出。
(1)導管a的作用是平衡壓強,可使分液漏斗內的液體順利流下,故答案為:平衡壓強,使濃鹽酸順利流下;
(2)實驗采用KMnO4和濃鹽酸反應的方法制取Cl2,反應還生成MnCl2,化學方程式為2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O,故答案為:2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O;
(3)B的作用是除去氯氣中混有的氯化氫氣體,故答案為:除去氯氣中混有的氯化氫氣體;
(4)SnCl4易揮發,冷水可降低溫度,避免四氯化錫氣化而損失,導致產率下降,故答案為:避免四氯化錫氣化而損失,導致產率下降;
(5)尾氣含有氯氣,為避免四氯化錫水解,應用堿石灰,故答案為:乙;
(6)錫粒中含銅雜質致E中產生CuCl2,但不影響F中產品的純度,原因是CuCl2熔點較高,不會隨四氯化錫液體溢出,故答案為:CuCl2熔點較高,不會隨四氯化錫液體溢出;
(7)蒸餾用到蒸餾燒瓶、溫度計、接收器、冷凝管、錐形瓶,無需吸濾瓶和分液漏斗,故答案為:A、C。


科目:高中化學 來源: 題型:
【題目】工業上用鉍酸鈉(NaBiNO3)檢驗溶液中的Mn2+,反應方程式為:4MnSO4+10NaBiO3+14H2SO4═4NaMnO4+5Bi2(SO4)3+3Na2SO4+口,下列說法不正確的是
A. 口內的物質為水,配平系數為14。
B. 若生成1mol NaMnO4,則轉移5mole-
C. 反應方程式中的硫酸可換為鹽酸
D. 溶液中有Mn2+的現象是溶液變為紫紅色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙酸乙酯廣泛用于藥物、染料、香料等工業,其制備原理為:![]()
甲、乙兩同學分別設計了如下裝置來制備乙酸乙酯。

請回答下列問題:
(1)下列說法不正確的是________。
A.加入試劑的順序依次為乙醇、濃硫酸、乙酸
B.飽和碳酸鈉的作用是中和乙酸、溶解乙醇、促進乙酸乙酯在水中的溶解
C.濃硫酸在反應中作催化劑和吸水劑,加入的量越多對反應越有利
D.反應結束后,將試管中收集到的產品倒入分液漏斗中,振蕩、靜置,待液體分層后即可從上口倒出上層的乙酸乙酯
(2)乙裝置優于甲裝置的理由是________。(至少說出兩點)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】漂白粉的主要成分是次氯酸鈣和氯化鈣。請回答下列問題:
(1)漂白粉長期露置在空氣中會變質,寫出漂白粉變質過程中涉及的化學方程式(若涉及氧化還原反應,請標注電子轉移情況):____________________________。
(2)某化學小組將完全變質后的漂白粉溶于水,向其中加入足量稀硝酸,共收集到標準狀況下448mL氣體,則該漂白粉中所含有效成份的質量為_____________(假設漂白粉中的其它成份不與硝酸反應)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨氣是重要的化工原料,工業上由N2和H2在一定條件下合成。
(1)已知H2的標準燃燒熱為△H1=-akJ·mol-1,NH3的標準燃燒熱為△H2=-bkJ·mol-1。則合成氨反應:N2(g)+3H2(g)![]() 2NH3(g)的△H3=_________ kJ·mol-1 (用含a、b的代數式表示)。
2NH3(g)的△H3=_________ kJ·mol-1 (用含a、b的代數式表示)。
(2)合成氨反應:N2(g)+3H2(g) ![]() 2NH3(g)在一定溫度下能自發進行,則△H3______0(填“>”或“<”),原因是__________。
2NH3(g)在一定溫度下能自發進行,則△H3______0(填“>”或“<”),原因是__________。
(3)一定溫度下,向體積為2L的密閉容器中通入一定量的N2和H2反生反應,有關物質的量隨反應時間的變化如圖所示。該溫度下,反應的平衡常數為_________________。
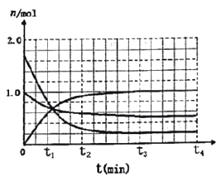
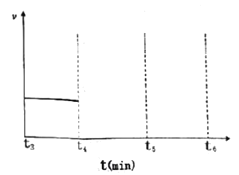
若在t4時刻,同時向體系中再通入0.5 mol N2和1moNH3,t5時刻重新達到平衡,請在下圖中畫出t4~t6時間段逆反應速率隨時間的變化圖_____________。
(4)文獻報道,常壓下把氫氣和用氦氣稀釋的氮氣分別通入一個加熱到570℃的電解池中,采用高質子導電性的SCY陶瓷(能傳遞H+)為介質可在電極上直接生成氨氣。陰極的反應方程式為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】過氧化鈉與水反應后滴加酚酞,酚酞先變紅后褪色。某小組欲探究其原因,進行以下實驗:①取反應后溶液加入二氧化錳后迅速產生大量氣體;實驗②、③中紅色均不褪去。下列分析錯誤的是

A. 過氧化鈉與水反應產生的氣體為O2
B. 過氧化鈉與水反應需要MnO2作催化劑
C. 實驗②、③證明使酚酞褪色的不是氫氧化鈉和氧氣
D. 過氧化鈉與水反應可能生成了具有漂白性的H2O2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,將3 mol A氣體和1 mol B氣體混合于固定容積為2 L的密閉容器中,發生反應:3A(g)+B(g) ![]() C(g)+2D(s)。2 min末該反應達到平衡,生成D的物質的量隨時間的變化情況如圖所示。下列判斷正確的是( )
C(g)+2D(s)。2 min末該反應達到平衡,生成D的物質的量隨時間的變化情況如圖所示。下列判斷正確的是( )
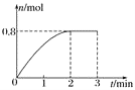
A. 若混合氣體的密度不再改變時,該反應不一定達到平衡狀態
B. 2 min后,加壓會使正反應速率加快,逆反應速率變慢
C. 反應過程中A和B的轉化率之比為3∶1
D. 開始到平衡,用A表示的化學反應速率為0.3 mol·L-1·min-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知充分燃燒a g乙炔(C2H2)氣體時生成1 mol二氧化碳氣體和液態水,并放出熱量b kJ,則表示乙炔燃燒熱的熱化學方程式正確的是( )
A.2C2H2(g)+5O2(g) =4CO2(g)+2H2O(g) ΔH=-4b kJ·mol-1
B.C2H2(g)+![]() O2(g) =2CO2(g)+H2O(l) ΔH=-2b kJ·mol-1
O2(g) =2CO2(g)+H2O(l) ΔH=-2b kJ·mol-1
C.C2H2(g)+![]() O2(g) =2CO2(g)+H2O(g) ΔH=+2b kJ·mol-1
O2(g) =2CO2(g)+H2O(g) ΔH=+2b kJ·mol-1
D.2C2H2(g)+5O2(g) =4CO2(g)+2H2O(l) ΔH=+4b kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖所示是以海水為原料,獲得某產物的工藝流程圖。已知在吸收塔中,溶液的pH顯著減小。試回答下列問題:

(1)圖中兩次氯化的作用是否相同________(選填“是”或“否”)。
(2)吸收塔中反應的化學方程式為_______________________________,第2次氯化的離子方程式為_________________________________________________。
(3)資料證實,在酸性介質中,第1次氯化過程中可用氧氣或空氣替代。但在實際工業生產中為什么不用更廉價的空氣替代氯氣________________________。
(4)本工藝的處理方法可簡單概括為“空氣吹出、X氣體吸收、氯化”。某同學認為在工業生產過程中對第1次氯化液直接蒸餾也可得到產物,不必進行上述過程,請對該同學的說法作出正確的評價___________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com