
【題目】某混合液中含有Ba2+,Mg2+,Ag+,現用NaOH溶液、鹽酸和Na2SO4溶液將這三種離子逐一沉淀分離。其流程圖如圖所示(寫出最佳答案)
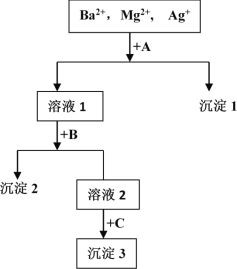
(1)沉淀的化學式:沉淀1______________,沉淀2______________,沉淀3______________;
(2)寫出混合液 + A的離子方程式_____溶液1 + B的離子方程式_________。
【答案】AgCl BaSO4或Mg(OH)2 Mg(OH)2或BaSO4 Ag++Cl-=AgCl↓ Ba2++ SO42-=BaSO4↓或Mg2++2OH-=Mg(OH)2↓
【解析】
溶液含有Ba2+、Mg2+、Ag+,應先加入HCl,生成AgCl沉淀,過濾后在加入Na2SO4,可得到BaSO4沉淀,最后加入NaOH,可得到Mg(OH)2沉淀,或者過濾后在加入NaOH,可得到Mg(OH)2沉淀,最后加入Na2SO4,可得到BaSO4沉淀,根據物質的性質書寫反應的離子方程式。
(1)根據以上分析可知沉淀1是AgCl,沉淀2是BaSO4或Mg(OH)2,沉淀3是Mg(OH)2或BaSO4;
(2)混合液+A反應的離子方程式為Ag++Cl-=AgCl↓,沉淀2是BaSO4或Mg(OH)2,溶液+B反應的離子方程式為Ba2++ SO42-=BaSO4↓或Mg2++2OH-=Mg(OH)2↓。


 暑假作業暑假快樂練西安出版社系列答案
暑假作業暑假快樂練西安出版社系列答案科目:高中化學 來源: 題型:
【題目】下列溶液中的氯離子物質的量濃度與 100 mL 1 mol·L-1 的 AlCl3 溶液中氯離子物質的量濃度相等的是
A.200 mL 1 mol·L-1 的 NaClB.200 mL 2 mol·L-1 的NH4Cl
C.100 mL 3 mol·L-1 的 KClD.100 mL 2 mol·L-1 的BaCl2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示甲、乙兩個裝置,所盛溶液體積和濃度均相同且足量,電極鋁和鎂都已除去表面氧化膜。當兩裝置電路中通過的電子都是1mol時,下列說法不正確的是
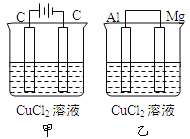
A. 溶液的質量減小程度:乙<甲
B. 溶液的導電能力變化:甲>乙
C. 甲中陰極和乙中鎂電極上析出物質質量:甲=乙
D. 電極反應式:甲中陽極:![]() -2e → Cl2↑,乙中正極:
-2e → Cl2↑,乙中正極:![]() + 2e → Cu
+ 2e → Cu
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬鈉是在1807年通過電解氫氧化鈉制得的,這個原理應用于工業生產,約在1891年才獲得成功。1921年實現了電解氯化鈉制鈉的工業方法,其反應原理是:2NaCl(熔融)![]() 2Na+Cl2↑。回答下列有關單質鈉的問題:
2Na+Cl2↑。回答下列有關單質鈉的問題:
(1)下列各項中屬于保存金屬鈉的正確方法是____。
A.放在棕色瓶中 B.放在細沙中
C.放在水中 D.放在煤油中
(2)鈉長時間放在空氣中,最后的產物主要成分是____。
A.Na2O B.Na2O2 C.NaOH D.Na2CO3
(3)將一小塊鈉放在水平放置的試管中部,用酒精燈加熱充分反應(如圖Ⅰ所示),請寫出該反應的化學方程式____________,生成物的顏色為____。將該試管冷卻后直立,滴加幾滴水(如圖Ⅱ所示),發生反應的化學方程式為____________,檢驗該反應產生的氣體的方法是________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將2 mol SO2和1 mol O2充入一容積固定的密閉容器中,在一定條件下發生反應:2SO2(g)+O2(g) ![]() 2SO3(g),下列物理量不再改變時,并不能說明化學反應已達到平衡狀態的是( )
2SO3(g),下列物理量不再改變時,并不能說明化學反應已達到平衡狀態的是( )
A. 混合氣體的密度
B. 混合氣體的壓強
C. 混合氣體的總物質的量
D. 混合氣體的平均相對分子質量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知 3.6 g 碳在 6.4 g 的氧氣中燃燒,至反應物耗盡,并放出 X kJ 熱量。已知單質 C(s)的燃燒熱數值為 Y kJ·mol-1,則 1 mol C(s)與 O2(g)反應生成 CO(g)的反應熱 ΔH 為( )
A. -Y kJ/mol B. -(10X-Y) kJ/mol C. -(5X-0.5Y) kJ/mol D. +(10X-Y) kJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】紅磷P(s)和Cl2(g)發生反應生成PCl3(g)和PCl5(g)。反應過程和能量關系如下圖所示(圖中的ΔH表示生成1 mol產物的數據)。根據上圖回答下列問題:
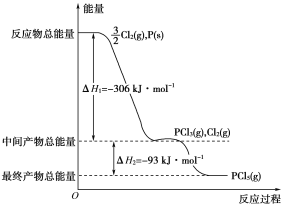
(1)P和Cl2反應生成PCl3的熱化學方程式是__________________________
(2)PCl5分解成PCl3和Cl2的熱化學方程式是_________________________
(3)P和Cl2分兩步反應生成1 mol PCl5的ΔH3=________,P和Cl2一步反應生成1 mol PCl5的ΔH4______ΔH3(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙烯、丙烯等低碳烯烴是重要的基本化工原料,隨著我國國民經濟的發展,對低碳烯烴的需求日漸攀升。回答下列問題:
(1)MTP(甲醇制丙烯)工藝是目前重要的化工技術。主反應為![]()
![]() 。反應歷程可按下列催化過程進行:
。反應歷程可按下列催化過程進行:
![]()
![]() 則
則![]() =___________。
=___________。
(2)MTP工藝中存在等多個副反應。其他條件都相同時,在某催化劑的作用下,反應溫度對甲醇轉化率和產物選擇性的影響如圖所示。已知:
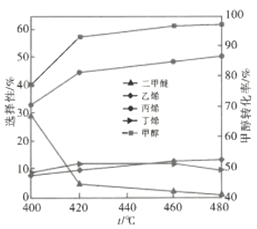
①主、副反應均為放熱反應,且均為有水蒸氣生成的氣體分子數增加的反應
②選擇性=(生成目的產物所消耗的原料量/轉化掉的原料量)×100%
據圖分析,若欲顯著提高乙烯的選擇性,不宜采取的措施是___________(填“改變溫度”或“改變催化劑”);圖中溫度低于480℃時甲醇的轉化率___________(填“是”或者“不是”)對應溫度下的平衡轉化率,判斷理由是___________;下列措施中可提高甲醇平衡轉化率的是___________(填標號)。
A.增大甲醇濃度
B.減小壓強
C.用干燥劑吸收水蒸氣
D.減小反應的平衡常數
(3)恒容條件下,若反應溫度為460℃,![]() 初始濃度為
初始濃度為![]() mol
mol![]() ,平衡轉化率為
,平衡轉化率為![]() ,丙烯的選擇性為48.3%,水蒸氣的平衡濃度為
,丙烯的選擇性為48.3%,水蒸氣的平衡濃度為![]() ,則丙烯的平衡濃度為_____________,主反應
,則丙烯的平衡濃度為_____________,主反應![]() 的平衡常數K(460℃)的計算式為___________。
的平衡常數K(460℃)的計算式為___________。
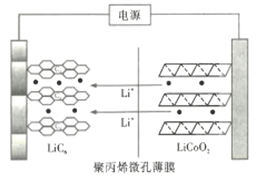
(4)丙烯可用于制備聚丙烯,聚丙烯微孔薄膜可用作鋰離子電池的隔膜。某種鋰離子電池充電時的示意圖如圖所示。![]() 中的
中的![]() 穿過隔膜向左遷移并嵌入石墨(用
穿過隔膜向左遷移并嵌入石墨(用![]() 表示)中。放電時
表示)中。放電時![]() 中的
中的![]() 又脫嵌向右遷移,則該電池放電時負極的電極反應式為___________。
又脫嵌向右遷移,則該電池放電時負極的電極反應式為___________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com