
【題目】氮和硫的化合物在工農業生產、生活中具有重要應用。請回答下列問題:
(1)航天領域中常用N2H4作為火箭發射的助燃劑。N2H4與氨氣相似,是一種堿性氣體,易溶于水,生成弱堿N2H4·H2O。用電離方程式表示N2H4·H2O顯堿性的原因是:____________________________________________。
(2)在恒溫條件下,1 mol NO2和足量C發生反應2NO2(g)+2C(s)![]() N2(g)+2CO2(g),測得平衡時NO2和CO2的物質的量濃度與平衡總壓的關系如圖所示:
N2(g)+2CO2(g),測得平衡時NO2和CO2的物質的量濃度與平衡總壓的關系如圖所示:
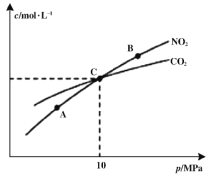
①A、B兩點的濃度平衡常數關系:Kc(A) ___________Kc(B)(填“<”或“>”或“=”)
②A、B、C三點中NO2的轉化率最高的是___________(填“A”或“B”或“C”)點。
③計算C點時該反應的壓強平衡常數Kp=___________MPa(Kp是用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)。
(3)已知:亞硝酸(HNO2)性質和硝酸類似,但它是一種弱酸。常溫下亞硝酸的電離平衡常數Ka=5.1×10-4;H2CO3的Ka1=4.2×10-7,Ka2=5.61×10-11。在常溫下向含有2mol碳酸鈉的溶液中加入1mol的HNO2后,則溶液中CO32-、HCO3-和NO2-的離子濃度由大到小的順序是______________________。
(4)已知:常溫下甲胺(CH3NH2)的電離常數為Kb,且pKb=-lgKb=3.4水溶液中有CH3NH2+H2OCH3NH3++OH-。常溫下向CH3NH2溶液滴加稀硫酸至c(CH3NH2)=c(CH3NH3+)時,則溶液pH=_______。
(5)一種煤炭脫硫技術可以把硫元素以CaSO4的形成固定下來,但產生的CO又會與CaSO4發生化學反應,相關的熱化學方程式如下:
①CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g) △H=+210.5kJ· mol-1
②CaSO4(s)+4CO(g) CaS(s)+ 4CO2(g) △H=-189.2 kJ· mol-1
反應CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g) △H=___________ kJ· mol-1
【答案】N2H4·H2O![]() N2H5++OH-(或N2H4+H2O
N2H5++OH-(或N2H4+H2O![]() N2H5++OH-) = A 2 c(HCO3-)>c(NO2-)>c(CO32-) 10.6 -399.7
N2H5++OH-) = A 2 c(HCO3-)>c(NO2-)>c(CO32-) 10.6 -399.7
【解析】
(1) N2H4結合H2O電離的氫離子使溶液呈堿性;
(2)①平衡常數只受溫度影響,據此判斷;
②增大壓強平衡向氣體體積減小的方向移動;
③在C點時,二氧化碳與二氧化氮的濃度相等,根據反應2NO2(g)+2C(s)![]() N2(g)+2CO2(g),可以知道氮氣的濃度為二氧化碳的一半,據此確定各成份氣體的體積分數,進而確定反應的壓強平衡常數Kp;
N2(g)+2CO2(g),可以知道氮氣的濃度為二氧化碳的一半,據此確定各成份氣體的體積分數,進而確定反應的壓強平衡常數Kp;
(3)弱酸電離常數越大,酸性越強,其酸根離子水解程度越小;
(4) 根據Kb=![]() =c(OH-)計算;
=c(OH-)計算;
(5) 利用蓋斯定律將②-①可得CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g)反應熱。
(1)肼易溶于水,它是與氨類似的弱堿,則電離生成OH-和陽離子,電離方程式為N2H4·H2O![]() N2H5++OH-,
N2H5++OH-,
因此,本題正確答案是:N2H4·H2O![]() N2H5++OH-;
N2H5++OH-;
(2)①平衡常數只受溫度影響,所以Kc(A) =Kc(B),
因此,本題正確答案是:=;
②增大壓強平衡向氣體體積減小的方向移動,該反應的正反應是氣體體積增大的反應,所以A、B、C三點中NO2的轉化率最高的是A點,
因此,本題正確答案是:A;
③在C點時,二氧化碳與二氧化氮的濃度相等,根據反應2NO2(g)+2C(s)![]() N2(g)+2CO2(g),可以知道氮氣的濃度為二氧化碳的一半,所以混合氣體中CO2的體積分數為
N2(g)+2CO2(g),可以知道氮氣的濃度為二氧化碳的一半,所以混合氣體中CO2的體積分數為![]() ,NO2的體積分數
,NO2的體積分數![]() ,N2的體積分數
,N2的體積分數![]() ,所以反應的壓強平衡常數Kp=
,所以反應的壓強平衡常數Kp=![]() =
= =2MPa,
=2MPa,
因此,本題正確答案是:2;
(3)2mol碳酸鈉的溶液中加入1mol的HNO2后,得到含有1mol碳酸鈉、1mol碳酸氫鈉和1mol亞硝酸鈉的混合液。由亞硝酸的電離平衡常數Ka=5.1×10-4,H2CO3的Ka1=4.2×10-7,Ka2=5.61×10-11,可判斷水解程度大小順序為CO32-> NO2-,CO32-水解生成HCO3-,水解的程度較小,所以溶液中CO32-離子、HCO3-離子和NO2-離子的濃度大小關系為c(HCO3-)>c(NO2-)>c(CO32-),
因此,本題正確答案是:c(HCO3-)>c(NO2-)>c(CO32-);
(4)電離常數Kb只隨溫度改變,常溫時,CH3NH2+H2OCH3NH3++OH-,當滴加稀硫酸至c(CH3NH2)=c(CH3NH3+)時,Kb=![]() =c(OH-),即c(OH-)= Kb=10-3.4mol/L,則c(H+)=
=c(OH-),即c(OH-)= Kb=10-3.4mol/L,則c(H+)=![]() =10-10.6,所以pH=-lg10-10.6=10.6,
=10-10.6,所以pH=-lg10-10.6=10.6,
因此,本題正確答案是:10.6;
(5) 利用蓋斯定律將②-①可得CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g)
△H=(-189.2 kJ· mol-1)-(+210.5kJ· mol-1)=-399.7 kJ· mol-1,
因此,本題正確答案是:-399.7。


科目:高中化學 來源: 題型:
【題目】下列關于晶體的說法正確的組合是( )
①分子晶體中都存在共價鍵
②在晶體中只要有陽離子就一定有陰離子
③金剛石、SiC、H2O、H2S晶體的熔點依次降低
④離子化合物中只有離子鍵沒有共價鍵,分子晶體中肯定沒有離子鍵
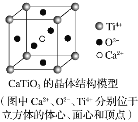
⑤CaTiO3晶體中(晶胞結構如圖所示)每個Ti4+和12個O2-相緊鄰
⑥SiO2晶體中每個硅原子與兩個氧原子以共價鍵相結合
⑦晶體中分子間作用力越大,分子越穩定
⑧氯化鈉溶于水時離子鍵被破壞
A. ①②③⑥B. ①②④C. ③⑤⑦D. ③⑤⑧
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】火力發電廠釋放出大量氮氧化合物(NOx)、SO2和CO2等氣體會造成環境問題。對燃煤廢氣進行脫硝、脫硫和脫碳等處理,可實現綠色環保、節能減排、廢物利用等目的。
(1)脫硝。利用甲烷催化還原NOx:
CH4(g)+ 4NO2(g)=4NO(g)+ CO2(g)+ 2H2O(g) △H1=-574 kJ/mol
CH4(g)+ 4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g) △H2=-1160 kJ/mol
甲烷直接將NO2還原為N2的熱化學方程式為___________。
(2)脫碳。將CO2轉化為甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
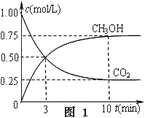

①在一恒溫恒容密閉容器中充入1 mol CO2和3 mol H2進行上述反應。測得CO2和CH3OH(g)濃度隨時間變化如圖1所示。回答:0~10 min內,氫氣的平均反應速率為___mol/(L·min);第10 min后,保持溫度不變,向該密閉容器中再充入1 mol CO2(g)和1 mol H2O(g),則平衡________(填“正向”、“逆向”或“不”)移動。
②如圖2,25℃時以甲醇燃料電池(電解質溶液為稀硫酸)為電源來電解300mL 某NaCl溶液,正極反應式為______。在電解一段時間后,NaCl溶液的pH值變為13(假設NaCl溶液的體積不變),則理論上消耗甲醇的物質的量為_____mol。
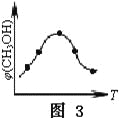
③取五份等體積的CO2和H2的混合氣體(物質的量之比均為1∶3),分別加入溫度不同、容積相同的恒容密閉容器中,發生上述反應,反應相同時間后,測得甲醇的體積分數φ(CH3OH)與反應溫度T的關系曲線如圖3所示,則上述CO2轉化為甲醇的反應的△H3____0(填“>”、“<”或“=”)。
(3)脫硫。燃煤廢氣經脫硝、脫碳后,與一定量氨氣、空氣反應,生成硫酸銨。硫酸銨水溶液呈酸性的原因是______(用離子方程式表示);室溫時,向(NH4)2SO4,溶液中滴人NaOH溶液至溶液呈中性,則所得溶液中微粒濃度大小關系c(Na+)_____c(NH3·H2O)。(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:①H+(aq)+OH-(aq)===H2O(l) ΔH1=-57.3 kJ·mol-1,
②H2(g)+![]() O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1,下列有關說法正確的是( )
O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1,下列有關說法正確的是( )
A. 向含0.1molNaOH的溶液中加入一定體積的0.1mol·L-1乙二酸,反應中的能量變化如圖所示
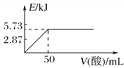
B. H2SO4(aq)+Ba(OH)2(aq)===BaSO4(s)+2H2O(l) ΔH=-114.6 kJ·mol-1
C. 氫氣的標準燃燒熱為241.8 kJ·mol-1
D. 若反應②中水為液態,則同樣條件下的反應熱:ΔH>ΔH2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合成氨反應過程中的能量變化如圖所示,下列說法正確的是
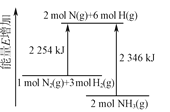
A.NH3的能量較低,比N2、H2更穩定
B.2NH3(g)→2N(g)+6H(g)-2346 kJ
C.N2(g)+3H2(g)![]() 2NH3(g)-92 kJ
2NH3(g)-92 kJ
D.加入催化劑,可以減小反應的熱效應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硅是重要的半導體材料,是構成現代電子工業的基礎。硅及其化合物在工業中應用廣泛,在工業上,高純硅可以通過下列流程制取:
![]()
完成下列填空:
(1)氯原子核外有_______種不同能量的電子,硅原子的核外電子排布式是_______________。
(2)碳與硅屬于同主族元素,熔沸點SiO2 ________CO2 (填寫“>”、“<”或“=”),其原因是_____________________________________________________。
(3)流程中由SiO2制粗硅的反應不能說明碳的非金屬性強于硅,原因是_________________;請寫出一個能說明碳的非金屬性強于硅的化學方程式______________________________。
(4)SiHCl3(g) + H2(g)![]() Si(s) + 3HCl(g) -Q (Q>0)
Si(s) + 3HCl(g) -Q (Q>0)
①上述反應的平衡常數表達式K=_____________;能使K增大的措施是_______________。
②一定條件下,在固定容積的密閉容器中,能表示上述反應達到平衡狀態的是________(選填編號)。
a.3v逆(SiHCl3)=v正(HCl) b.混合氣體的壓強不變
c.K保持不變 d.c(SiHCl3)∶c(H2)∶c(HCl)=1∶1∶3
③一定溫度下,在2L密閉容器中進行上述反應,5min后達到平衡,此過程中固體質量增加0.28g,此時HCl的化學反應速率為 ________________ 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室制備溴苯的反應裝置如下圖所示,關于實驗操作或敘述錯誤的是

A. 向圓底燒瓶中滴加苯和溴的混合液前需先打開K
B. 實驗中裝置b中的液體逐漸變為淺紅色
C. 裝置c中的碳酸鈉溶液的作用是吸收溴化氫
D. 反應后的混合液經稀堿溶液洗滌、結晶,得到溴苯
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮及其化合物是科學家們一直在探究的問題,它們在工農業生產和生命活動中起著重要的作用。回答下列問題。
I.NOx和SO2在空氣中存在下列平衡:
2NO(g)+O2(g)2NO2(g)△H=﹣113.0kJmol﹣1
2SO2(g)+O2(g)2SO3(g)△H=﹣196.6kJmol﹣1
SO2通常在二氧化氮的存在下,進一步被氧化,生成SO3.
(1)寫出NO2和SO2反應的熱化學方程式為_________.
(2)隨溫度升高,該反應化學平衡常數變化趨勢是_____.
II.(1)目前,應用NH3的催化還原法來進行煙氣氮氧化物脫除,化學反應可表示為:2NH3(g)+NO(g)+NO2(g)== 2N2(g)+3H2O(g) △H<0,該反應中,反應物總能量_____(填“>”、“<”或“=”)生成物總能量。
(2)已知4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) ΔH=-1800 kJ·mol-1,將2 mol NH3、3 mol NO的混合氣體分別置于a、b、c三個10 L恒容密閉容器中,使反應在不同條件下進行,反應過程中c(N2)隨時間的變化如圖所示。
5N2(g)+6H2O(g) ΔH=-1800 kJ·mol-1,將2 mol NH3、3 mol NO的混合氣體分別置于a、b、c三個10 L恒容密閉容器中,使反應在不同條件下進行,反應過程中c(N2)隨時間的變化如圖所示。
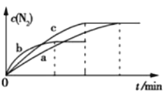
①與容器a中的反應相比,容器b中的反應改變的實驗條件可能是_______,判斷的依據是___________________。
②一定溫度下,下列能說明反應已達到平衡狀態的是____
A.H2O(g)與NO的生成速率相等 B.混合氣體的密度保持不變
C.ΔH保持不變 D.容器的總壓強保持不變
(3)用NH3和Cl2反應可以制備具有強氧化性的三氯胺(三氯胺在中性、酸性環境中會發生強烈水解,生成具有強殺菌作用的物質),方程式為3Cl2(g)+NH3(g)![]() NCl3(l)+3HCl(g),向容積均為1L的甲、乙兩個恒溫(反應溫度分別為400℃、T℃)容器中分別加入2molCl2和2molNH3,測得各容器中n(Cl2)隨反應時間t的變化情況如下表所示:
NCl3(l)+3HCl(g),向容積均為1L的甲、乙兩個恒溫(反應溫度分別為400℃、T℃)容器中分別加入2molCl2和2molNH3,測得各容器中n(Cl2)隨反應時間t的變化情況如下表所示:
t /min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(Cl2)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①T℃__________400℃(填“>”或“<”)。
②該反應的ΔH__________0(填“>”或“<”)。
③該反應自發進行的條件是__________(填高溫、低溫、任何溫度)。
④對該反應,下列說法正確的是_________(填選項字母)。
A.若容器內氣體密度不變,則表明反應達到平衡狀態
B.若容器內Cl2和NH3物質的量之比為3∶1,則表明反應達到平衡狀態
C.反應達到平衡后,其他條件不變,在原容器中按![]() 繼續充入一定量反應物,達新平衡后Cl2的轉化率增大
繼續充入一定量反應物,達新平衡后Cl2的轉化率增大
D.反應達到平衡后,其他條件不變,加入一定量的NC13,平衡將向逆反應方向移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,濃度都是1mol·L-1的兩種氣體X2和Y2,在密閉容器中反應生成氣體Z,反應2 min后,測得參加反應的X2為0.6 mol·L-1,用Y2濃度變化表示的化學反應速率v(Y2)=0.1 mol·(L·min)-1,生成的c(Z)為0.4 mol·L-1,則該反應的反應式可以表示為( )
A. X2+2Y2![]() 2XY2 B. 2X2+Y2
2XY2 B. 2X2+Y2![]() 2X2Y
2X2Y
C. 3X2+Y2![]() 2X3Y D. X2+3Y2
2X3Y D. X2+3Y2![]() 2XY3
2XY3
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com