
【題目】硫化氫氣體在資源利用和環境保護等方面均有重要應用。
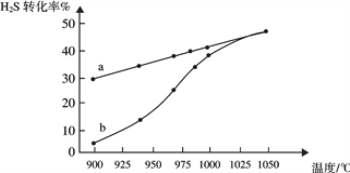
(1)工業采用高溫分解H2S制取氫氣,2H2S(g) ![]() 2H2(g) + S2(g),在膜反應器中分離出H2。在容積為 2L 的恒容密閉容器中,控制不同溫度進行此反應。H2S的起始物質的量均為 1mol,實驗過程中測得H2S的轉化率如圖所示。曲線 a 表示H2S的平衡轉化率與溫度的關系,曲線 b 表示不同溫度下反應經過相同時間時H2S的轉化率。
2H2(g) + S2(g),在膜反應器中分離出H2。在容積為 2L 的恒容密閉容器中,控制不同溫度進行此反應。H2S的起始物質的量均為 1mol,實驗過程中測得H2S的轉化率如圖所示。曲線 a 表示H2S的平衡轉化率與溫度的關系,曲線 b 表示不同溫度下反應經過相同時間時H2S的轉化率。
①反應2H2S(g) ![]() 2H2(g) + S2(g)的ΔH_________(填“>”“<”或“=”)0。
2H2(g) + S2(g)的ΔH_________(填“>”“<”或“=”)0。
②985℃時,反應經過5 s達到平衡狀態,此時H2S的轉化率為40%,則用H2表示的反應速率為v(H2) =___________。
③隨著H2S分解溫度的升高,曲線b向曲線a逐漸靠近,其原因是___________。
(2)將H2S和空氣的混合氣體通入FeCl3 、FeCl2 、CuCl2的混合溶液中反應回收S,其物質轉化如下圖所示。
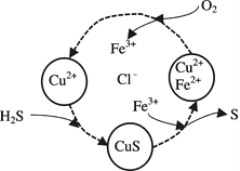
①在圖示的轉化中,化合價不變的元素是____________。
②在溫度一定和不補加溶液的條件下,緩慢通入混合氣體,并充分攪拌。欲使生成的硫單質中不含CuS,可采取的措施有____________。
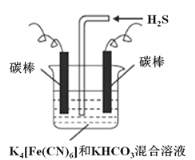
(3)工業上常采用上圖電解裝置電解K4[Fe(CN)6]和KHCO3混合溶液,電解一段時間后,通入H2S 加以處理。利用生成的鐵的化合物K3[Fe(CN)6]將氣態廢棄物中的H2S 轉化為可利用的S,自身轉化為K4[Fe(CN)6]。
①電解時,陽極的電極反應式為___________。
②當有16 g S析出時,陰極產生的氣體在標準狀況下的體積為___________。
【答案】 > 0.04mol/(L·s) 溫度升高,反應速率加快,達到平衡所需時間縮短 Cu、Cl、H 增加氧氣的通入量或增加起始時c(Fe3+) Fe(CN)6]4--e-=[Fe(CN)6]3- 11.2L
【解析】(1)①根據溫度升高,轉化率增大,可知平衡正移分析;②根據轉化率求出反應的量,再求反應速率;③根據溫度對速率的影響分析;
(2)①根據圖中各元素化合價變化分析;②欲使生成的硫單質中不含CuS,則硫離子不能剩余,硫離子完全被氧化為S單質,據此分析;
(3)①電解時陽極發生失電子的氧化反應,將[Fe(CN)6]4-轉化為Fe(CN)6]3-,化合價升高;②因為H2S轉化為可利用的S,則當有16gS析出時,轉移![]() ×2=1mol電子,又電解時陰極反應式為2HCO3-+2 e-═H2↑+2CO32-,根據轉移電子數相等計算。
×2=1mol電子,又電解時陰極反應式為2HCO3-+2 e-═H2↑+2CO32-,根據轉移電子數相等計算。
(1)①由圖象可知,溫度升高,轉化率增大,則平衡正移,所以正方向為吸熱方向,即△H>0,故答案為:>;
②H2S的起始濃度均為![]() molL-1,若985℃時,反應經5s達到平衡,此時H2S的轉化率為40%,則參加反應的硫化氫為
molL-1,若985℃時,反應經5s達到平衡,此時H2S的轉化率為40%,則參加反應的硫化氫為![]() molL-1×40%=0.2molL-1,v=
molL-1×40%=0.2molL-1,v=![]() =
=![]() molL-1s-1=0.04molL-1s-1,故答案為:0.04molL-1s-1;
molL-1s-1=0.04molL-1s-1,故答案為:0.04molL-1s-1;
③隨著溫度升高,反應速率逐漸加快,達到平衡所需時間縮短,所以曲線b向曲線a逼近,故答案為:溫度升高,反應速率加快,達到平衡所需時間縮短;
(2)①根據圖中各元素化合價知,Cu元素化合價都是+2價、H元素化合價都是+1價、Cl元素化合價都是-1價,所以化合價不變的是Cu、H、Cl元素,故答案為:Cu、H、Cl;
②欲使生成的硫單質中不含CuS,則硫離子不能剩余,即硫離子完全被氧化為S單質,所以氧氣必須過量,采取的措施可以是提高混合氣體中空氣的比例、增加氧氣的通入量或增加起始時c(Fe3+),故答案為:提高混合氣體中空氣的比例、增加氧氣的通入量或增加起始時c(Fe3+);
(3)①電解時陽極發生失電子的氧化反應,將[Fe(CN)6]4-轉化為Fe(CN)6]3-,則電極反應式為[Fe(CN)6]4--e-═[Fe(CN)6]3-,故答案為:[Fe(CN)6]4--e-═[Fe(CN)6]3-;
②因為H2S轉化為可利用的S,則當有16gS析出時,轉移![]() ×2=1mol電子,又電解時陰極反應式為2HCO3-+2 e-═H2↑+2CO32-,所以根據轉移電子數相等,陰極產生的氣體在標準狀況下的體積為
×2=1mol電子,又電解時陰極反應式為2HCO3-+2 e-═H2↑+2CO32-,所以根據轉移電子數相等,陰極產生的氣體在標準狀況下的體積為![]() mol×22.4L/mol=11.2L,故答案為:11.2L。
mol×22.4L/mol=11.2L,故答案為:11.2L。


科目:高中化學 來源: 題型:
【題目】短周期金屬元素甲~戊在元素周期表中的相對位置如右表所示,下面判斷正確的是
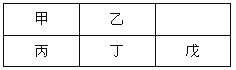
A. 原子半徑:丙<丁<戊B. 金屬性:甲>丙
C. 氫氧化物堿性:丙>丁>戊D. 最外層電子數:甲>乙
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列指定微粒的數目相等的是
A. 等質量的乙烯和丙烯中含有的共用電子對數
B. 等物質的量的水與重水含有的中子數
C. 同溫、同壓、同體積的CO和NO含有的質子數
D. 等物質的量的鐵和鋁分別與足量鹽酸完全反應時轉移的電子數
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X溶液中可能含有下列8種離子中的幾種:Fe3+、Fe2+、Na+、NH4+、CO32、Cl、SO32、SO42。某同學為確定其成分,設計并完成以下實驗(不考慮水解,所加試劑均足量):
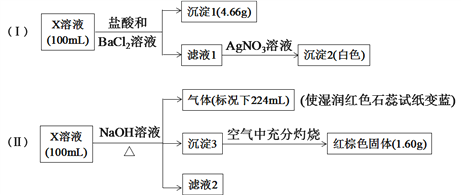
下列說法正確的是
A. X溶液中一定存在Na+、SO32、SO42、CO32
B. X溶液中一定存在NH4+、Na+、SO42,至少含有Fe3+、Fe2+離子中的一種
C. 取少量X溶液,先加入適量氯水,再加少量KSCN溶液,若溶液呈血紅色,則含有Fe2+
D. X溶液中一定含有Cl,且c(Cl)≥0.1mol·L1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與社會、生活密切相關,下列說法不正確的是
A. 天然氣是高效清潔燃料和重要的化工原料
B. 人造放射性同位素,在工農業、醫療等方面有重要用途
C. 氫鍵在生命現象中也起著重要作用
D. 芳香族化合物都有芳香性氣味
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】通常情況下,苯的化學性質比較穩定,這是因為 ( )
A.苯不能使高錳酸鉀酸性溶液褪色B.苯不與溴水發生加成反應
C.苯的分子結構決定的D.苯是芳香烴
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】能源是人類生活和社會發展的基礎,研究化學反應中的能量變化,有助于更好地利用化學反應為生產和生活服務。
(1)甲硅烷(SiH4)是一種無色氣體,遇到空氣能發生爆炸性自燃。
① 甲硅烷(SiH4)固態時屬于__________ 晶體。
② 已知室溫下1g甲硅烷自燃生成SiO2和液態水放出熱量44.6kJ,則其熱化學方程式為____________。
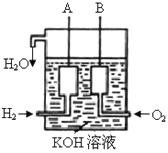
(2)美國阿波羅宇宙飛船上使用了一種新型電池裝置,其構造如下圖所示,A、B兩個電極均由多孔的炭塊組成。該電池的負極反應式為:_____________________。若該電池工作時增加了1mol H2O,電路中轉移電子的物質的量為__________。
(3)化學反應A2+B2=2AB的能量變化如圖所示,則下列說法正確的是____________。
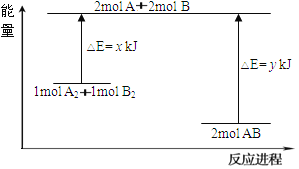
A. 該反應是吸熱反應
B. 斷裂1mol A-A鍵和1mol B-B鍵放出x kJ的能量
C. 斷裂2mol A-B鍵需要吸收y kJ的能量
D. 2mol AB的總能量高于1mol A2和1mol B2的總能量
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com