
【題目】在某一恒溫恒壓容器中發生如下反應:A(g)+B(g)![]() 2C(g)+D(g)△H<0。t1時刻達到平衡后,在t2時刻改變某一條件,其反應過程如圖。下列說法正確的是
2C(g)+D(g)△H<0。t1時刻達到平衡后,在t2時刻改變某一條件,其反應過程如圖。下列說法正確的是

A. t2時刻改變的條件可能是向密閉容器中加C
B. I、II兩過程達到平衡時,A的體積分數I >II
C. 0~t2時,V正>V逆
D. I、II兩過程達到平衡時,平衡常數I
科目:高中化學 來源: 題型:
【題目】把3mol P和2.5mol Q置于2L密閉容器中,發生如下反應:3P(g)+Q(g)xM(g)+2N(g),5min后達到平衡生成1mol N,經測定這5min內 M的平均速率是0.1mol/(Lmin),下列敘述錯誤的是( )
A.5min內P的平均反應速率為0.15mol/(Lmin)
B.Q的平衡濃度為1mol/L
C.Q的轉化率為25%
D.x是2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合成藥物的中間體M的合成路線如下:
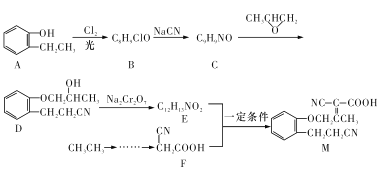
已知:①RX![]() RCN; ②RCH2COOH
RCN; ②RCH2COOH![]()
![]() 。
。
請回答:
(1)D→E的反應類型是_______________。
(2)下列說法不正確的是_____________(填字母)。
A.化合物B的官能團有羥基和氯原子
B.1 mol化合物B最多可消耗3 mol NaOH
C.化合物C至少有12個原子在同一平面
D.化合物D能發生加成反應和消去反應
(3)寫出E+F→M的化學反應方程式:_____________________________。
(4)寫出符合下列條件的C的所有同分異構體:![]() 、
、 、
、 、________。
、________。
①分子中除苯環外還含有五元環,是苯環的鄰位二取代物;
②IR譜顯示存在(C=N),且能發生銀鏡反應。
(5)請結合題給信息,設計以CH3CH2Cl為原料制備F的合成路線(用流程圖表示,無機試劑任選)____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)M由兩種短周期元素組成,每個M分子含有18個電子,其分子球棍模型如圖所示。測得M的摩爾質量為32 g/mol。面出編號為2的原子結構示意圖:_________。
(2)在常溫常壓和光照條件下,N2在催化劑(TiO2)表面與H2O反應,生成1mol NH3和O2時的能量變化值為382.5 lkJ,達到平衡后此反應NH3生成量與溫度的實驗數據如下表所示。則該反應的熱化學方程式為______。
T/K | 303 | 301 | 323 |
NH3生成量/(10-1mol) | 4.3 | 5.9 | 6.0 |
(3)在溶液中,一定濃度的NH4+能溶解部分Mg(OH)2固體,反應如下:2 NH4+ (aq)+Mg(OH)2(s)![]() Mg2+( aq)+ 2NH3·H2O( aq)
Mg2+( aq)+ 2NH3·H2O( aq)
寫出上述反應的平衡常數表達式______________。
某研究性學習小組為探究Mg2+與NH3·H2O反應形成沉淀的情況,設計如下兩組實驗:
實驗① | 等體積1mol/L氨水和0.1 mol/LMgCl2溶液混合 | 生成白色沉淀 |
實驗② | 等體積0.1mol/L氨水和l mol/LMgCl2溶液混合 | 無現象 |
請結合平衡常數表達式分析實驗①②產生不同現象的原因:_____________________。
(4)在室溫下,化學反應I- (aq)+ClO-( aq)=IO-( aq)+Cl-( aq)的反應物初始濃度、溶液中的氫氧根離子初始濃度及初始速率間的關系如下表所示:
實驗編號 | I-的初始濃度( mol·L-1) | ClO-的初始濃度( mol·L-1) | OH-的初始濃度( mol·L-1) | 初始速率v(mol·L-1··s-1) |
1 | 2×10-3 1.5×10-3 | 1.00 | 1.8×10-4 | |
2 | a | 1.5×10-3 | 1.00 | 3.6×10-4 |
3 | 2×10-3 | 3×10-3 | 2.00 | 1.8×10-4 |
4 | 4×10-3 | 3×10-3 | 1.00 | 7.2×10-4 |
已知表中初始反應速率與有關離子濃度關系可以表示為:v=kc(I-)c(ClO-)bc(OH-)c(溫度一定時,k為常數)。
①設計實驗2和實驗4的目的是_________;
②計算b、c的值:b=________,c=_______;
③若實驗編號4的其他濃度不變,僅將溶液的酸堿值變更為pH=13,反應的初始速率v=_____mol·L-l·s-1。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關物質性質的應用正確的是
A.氯化鋁是一種電解質,可用于電解法制鋁
B.二氧化硅不與強酸反應,可用石英器皿盛放氫氟酸
C.生石灰能與水反應,可用來干燥氯氣
D.液氨汽化時要吸收大量的熱,可用作制冷劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉛蓄電池反應為:Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O.下列說法中正確的是( )
2PbSO4+2H2O.下列說法中正確的是( )
A.PbO2得電子,被氧化
B.鉛蓄電池工作過程中每通過2mol電子,負極質量減少207g
C.電流是由PbO2經外電路流向Pb
D.電池放電時,溶液酸性增強
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com