
【題目】分析城市空氣樣本,主要污染物為可吸入顆粒物pm2.5、NOx、SO2等,其主要來源為燃煤和機動車尾氣排放等.
(1)某同學為檢測樣本中所含成份,將樣本用蒸餾水處理制成待測試樣,設計實驗及實驗現象如圖:
①該實驗能確認存在的陽離子是 .
②該實驗檢測出樣本中有NO3﹣ , 根據是(用化學方程式解釋) .
③根據該實驗能否確定樣本中含有SO32﹣ , (填“能”或“否”),若要確定SO32﹣ , 所需的實驗藥品可以是 .
(2)PM2.5是指大氣中直徑小于或等于2.5μm(1μm=103nm)的顆粒物.下列說法不正確的是(填字母序號).
a.PM2.5主要來源于火力發電、工業生產、汽車尾氣排放等過程
b.PM2.5顆粒小,所以對人體無害
c.直徑介于1~2.5μm的顆粒物分散到空氣中可形成膠體
d.推廣使用電動汽車,可以減少PM2.5的污染
(3)科研工作者用五年時間研究出利用石灰乳除工業燃煤尾氣中的硫(SO2、SO3)和氮(NO、NO2)的新工藝,既能凈化尾氣,又能獲得應用廣泛的CaSO4和Ca(NO2)2 . 
①CaSO4可以調節水泥的硬化時間.尾氣中SO2與石灰乳反應生成CaSO4的化學方程式為 .
②Ca(NO2)2可制成混凝土防凍劑、鋼筋阻銹劑等.尾氣中NO、NO2與石灰乳反應生成Ca(NO2)2的化學方程式 .
【答案】
(1)Na+、NH4+、K+;3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,2NO+O2=2NO2;否;酸性高錳酸鉀溶液
(2)bc
(3)2SO2+O2+2Ca(OH)2═2CaSO4+2H2O;NO+NO2+Ca(OH)2═Ca(NO2)2+H2O
【解析】解:(1)①物質焰色反應為黃色,所以含有鈉離子,和強堿共熱反應產生氨氣,能使石蕊試紙變藍,證明含有銨根離子,加入硝酸酸化的硝酸銀會產生白色沉淀,證明含有氯離子或是亞硫酸根離子中的一種,先加鹽酸再加入氯化鋇,產生白色沉淀,證明含有硫酸根離子,溶液中加入幾滴硫酸,再加入金屬銅,可以產生紅棕色的氣體,證明原溶液含有硝酸根離子,透過鈷玻璃觀察焰色反應呈現紫色,證明含鉀離子,一定含有的鉀離子是Na+、NH4+、K+ ,
所以答案是:Na+、NH4+、K+; ②溶液中加入幾滴硫酸,再加入金屬銅,可以產生紅棕色的氣體,證明原溶液含有硝酸根離子,金屬銅可以和硝酸反應產生硝酸銅、一氧化氮和水,一氧化氮遇到空氣迅速變為紅棕色,即:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,2NO+O2=2NO2 , 所以答案是:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,2NO+O2=2NO2;③根據該實驗不能確定樣本中含有SO32﹣ , 加入硝酸酸化的硝酸銀會產生白色沉淀,證明可能含有氯離子或是亞硫酸根離子中的一種,亞硫酸根離子可以和硝酸之間反應得到硫酸根離子,亞硫酸根離子可以使高錳酸鉀褪色,但是硫酸根離子不能,可以采用高錳酸鉀檢驗亞硫酸根離子的存在,所以答案是:否;酸性高錳酸鉀溶液;(2)a.PM2.5是指大氣中直徑小于或等于2.5μm的顆粒物.它的主要來源是日常發電、工業生產、汽車尾氣排放等過程中經過燃燒而排放的殘留物,故a正確;
b.PM2.5表面積大,具有吸附性,能吸附大量有毒物質,故b錯誤;
c.膠體微粒直徑在10﹣7m~10﹣9m之間,PM2.5粒子的大小不符合,故c錯誤;
d.減少機動車尾氣排放,減少了煙塵,能降低空氣中PM2.5,故d正確;
故選:bc;(3)①尾氣中SO2與氧氣和石灰乳反應生成CaSO4和水,反應方程式為:2SO2+O2+2Ca(OH)2═2CaSO4+2H2O所以答案是:2SO2+O2+2Ca(OH)2═2CaSO4+2H2O;
②尾氣中NO、NO2與石灰乳反應生成Ca(NO2)2和水,反應方程式為NO+NO2+Ca(OH)2═Ca(NO2)2+H2O;所以答案是:NO+NO2+Ca(OH)2═Ca(NO2)2+H2O.


 一線名師提優試卷系列答案
一線名師提優試卷系列答案 陽光試卷單元測試卷系列答案
陽光試卷單元測試卷系列答案科目:高中化學 來源: 題型:
【題目】實驗室制取氯氣的化學方程式:4HCl(濃)+MnO2 ![]() Cl2↑+MnCl2+2H2O,
Cl2↑+MnCl2+2H2O,
(1)反應物HCl中氯元素的化合價 .
(2)在該氧化還原反應中,MnO2 做劑,錳元素被 . 而HCl在反應中表現的性質包括和 .
(3)若有6molCl2生成時,反應中轉移mol電子.
(4)寫出該反應的離子方程式 , 用雙線橋法標出電子轉移的方向和數目: .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在1LK2SO4和CuSO4的混合溶液中,C(SO42﹣)=2molL﹣1 , 用石墨作電極電解該溶液,當通電一段時間后,兩極均收集到22.4L(標況)氣體,則原溶液中k+的物質的量濃度為( )
A.2molL﹣1
B.3 molL﹣1
C.1molL﹣1
D.0.5 molL﹣1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用50mL 0.50molL﹣1鹽酸與50mL 0.55molL﹣1 NaOH溶液,在如圖所示的裝置中進行中和反應,測定強酸與強堿反應的反應熱. 
起始溫度t1/℃ | 終止溫度t2/℃ | 溫度差 | |||
HCl | NaOH | 平均值 | |||
1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(1)在該實驗中,量取50mL鹽酸或NaOH溶液,需要用到的玻璃儀是;
(2)裝置中大、小燒杯之間填滿碎泡沫塑料的目的是;
(3)某同學實驗記錄的數據如上表所示,其中記錄的終止溫度是指溫度;
(4)計算該實驗發生中和反應時放出的熱量為kJ[中和后生成的溶液的比熱容c=4.18J(g℃)﹣1 , 稀溶液的密度都為1gcm﹣3];
(5)如果用50mL 0.55mol/L的氨水(NH3H2O)代替NaOH溶液進行上述實驗,通過測得的反應熱計算中和熱,其中和熱△H會偏大,其原因是 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CO是火力發電廠釋放出的主要尾氣,為減少對環境污染,發電廠試圖采用CO與Cl2在催化劑的作用下合成光氣(COCl2).某溫度下,向2L的密閉容器中投入一定量的CO和Cl2 , 在催化劑的作用下發生反應:CO(g)+Cl2(g)COCl2(g)△H=a kJ/mol
反應過程中測定的部分數據如表:
t/min | n (CO)/mol | n (Cl2)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
(1)比較各時段平均速率v(COCl2):v(0﹣1)v(0﹣2);v(0﹣2)v(1﹣2) (填“>”、“=”或“<”).
(2)在2min~4min間,v(Cl2)正v(Cl2)逆 (填“>”、“=”或“<”),該溫度下K=
(3)已知X、L可分別代表溫度或壓強,如圖表示L一定時,CO的磚化率隨X的變化關系.
X代表的物理量是;a0 (填“>”,“=”,“<”),依據是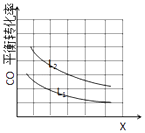
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各物質中所含原子個數由多到少的順序正確的是
①0.5mol的氯氣②標準狀況下22.4L氫氣③4℃時9mL的水④0.2mol的磷酸
A. ①④③② B. ④③②① C. ②④③① D. ①④②③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏加德羅常數的數值,下列敘述正確的是( )
A.a g C2H4和C3H6的混合物所含原子總數為 ![]()
B.常溫常壓下,14 g由N2與CO組成的混合氣體含有的原子數目為NA
C.標準狀況下,22.4 L H2O含有的分子數為 NA
D.物質的量濃度為0.5 mol·L1的MgCl2溶液中,含有Cl個數為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列事實不能用鍵能的大小來解釋的是( )
A.N元素的電負性較大,但N2的化學性質很穩定
B.稀有氣體一般難發生反應
C.HF,HCl,HBr,HI的穩定性逐漸減弱
D.F2比O2更容易與H2反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于CH4的敘述中不正確的是
A. CH4是無色、無味、極難溶于水的氣體
B. CH4的鍵長相等,鍵角相同,正四面體結構
C. CH4能使酸性高錳酸鉀溶液褪色
D. CH4和Cl2在光照條件下反應得到多種油狀物質
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com