
(1)固定和利用CO2能有效地利用資源,并減少空氣中的溫室氣體。工業上有一種用CO2來生產甲醇燃料的方法:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。某科學實驗將6molCO2和8molH2充入2L密閉容器中,測得H2的物質的量隨時間變化如右圖所示(實線)。圖中數據a(1,6)代表的意思是:在l min時H2的物質的量是6mol。
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。某科學實驗將6molCO2和8molH2充入2L密閉容器中,測得H2的物質的量隨時間變化如右圖所示(實線)。圖中數據a(1,6)代表的意思是:在l min時H2的物質的量是6mol。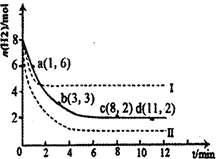
①下列時間段平均反應速率最大的是__________,最小的是______________。
| A.0~1min | B.1~3min | C.3~8min | D.8~11min |

(12分)(1)①A、D ②升高溫度,增大壓強或者是增大CO2濃度(各2分)
(2)v(Ⅲ)>v(Ⅱ)>v(Ⅰ)(2分);Ⅱ (2分)
解析試題分析:(1)①由圖1可知,0~1min內氫氣的變化量為8mol-6mol=2mol;
B.1~3min內氫氣的變化量為6mol-3mol=3mol,平均1min變化量為1.5mol;
C.3~8min內氫氣的變化量為3mol-2mol=1mol,平均1min變化量為0.2mol;
D.8~11min達平衡狀態,氫氣的物質的量不再變化.
故1~3min速率增大,8~11min速率最小.
故答案為:A;D.
②對于可逆反應CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1,正反應是體積減小的放熱反應.
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1,正反應是體積減小的放熱反應.
由圖1可知,曲線Ⅰ最先到達平衡,平衡時氫氣的物質的量增大,故改變條件應增大反應速率且平衡向逆反應移動,可以采取的措施為:升高溫度.
曲線Ⅱ到達平衡的時間比原平衡短,平衡時氫氣的物質的量減小,故改變條件應增大反應速率且平衡向正反應移動,可以采取的措施為:增大壓強或者是增大CO2濃度.
故答案為:升高溫度;增大壓強或者是增大CO2濃度.
(2)由圖2可知,在0~30h內,甲烷的物質的量變化量為△n(Ⅰ)<△n(Ⅱ)<△n(Ⅲ),故在0~30h內,CH4的平均生成速率v(Ⅲ)>v(Ⅱ)>v(Ⅰ);
由圖2可知反應開始后的12小時內,在第Ⅱ種催化劑的作用下,收集的CH4最多.
故答案為:v(Ⅲ)>v(Ⅱ)>v(Ⅰ);Ⅱ.
考點:物質的量或濃度隨時間的變化曲線;反應速率的定量表示方法


科目:高中化學 來源: 題型:填空題
現有反應:mA(g)+ B(g) 2C(g),達到平衡后,當升高溫度時,A的轉化率變小;當減小壓強時,混合體系中C的質量分數不變,則:
2C(g),達到平衡后,當升高溫度時,A的轉化率變小;當減小壓強時,混合體系中C的質量分數不變,則:
(1)該反應的△H 0(填“>”或“<”),且m 1(填“>”“=”“<”)。
(2)若加入B(假設容器的體積不變),則A的轉化率 ,B的轉化率 。 (填“增大”“減小”或“不變”)
(3)若B是有色物質,A、C均無色,則加入C(假設容器的體積不變)時混合物顏色 ,而維持容器內壓強不變,充入氖氣時,混合物顏色 (填“變深”“變淺”或“不變”)。
(4)一定溫度下,向1L密閉容器中加入1mol C(g)使其分解,氣體A的物質的量隨時間的變化如下圖所示。則0~2 min內的平均反應速率υ(C)= 。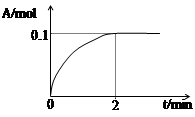
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
有兩個密閉容器A和B,A容器中有一個移動的活塞能使容器內保持恒壓,B容器能保持恒容。起始時向這兩個容器中分別充入等量的體積比為2:l的SO2和O2的混合氣體,并使A和B容積相等(如圖所示),在保持400℃的溫度下使之發生如下反應:2SO2+O2 2SO3。填寫下列空白:
2SO3。填寫下列空白:
(1)SO2的轉化率α(A) α(B)。(填“<”、“>”或“=”)
(2)達到(1)所述平衡時,若向兩容器中通入少量的氬氣,A容器化學平衡 移動。(填“正向”、“逆向”或“不”)
(3)達到(1)平衡后,向容器中充入等量的原反應氣體,再次達到平衡后,B容器中SO3在混合氣體中的體積分數 。(填“增大”、“減小”或“不變”)
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
中國尿素合成塔(尿塔)使用壽命僅為歐美國家的1/4。為此北京鋼鐵研究 院對四川瀘天化尿塔腐蝕過程進行研究,得出下列腐蝕機理: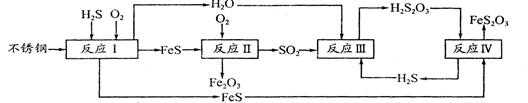
(1)H2S來自合成尿素的天然氣。在380 K、體積為2 L的密閉容器中,存在如下反應:H2(g)+S(s) H2S(g) △H=+21.6kJ·mol-1。反應達到平衡時H2、S、H2S的物質的量均為3 mol,則380 K時該反應的化學平衡常數為______;下列對該反應分析正確的是______(填字母序號)。
H2S(g) △H=+21.6kJ·mol-1。反應達到平衡時H2、S、H2S的物質的量均為3 mol,則380 K時該反應的化學平衡常數為______;下列對該反應分析正確的是______(填字母序號)。
(2)在反應I中發生的化學反應為______。
(3)研究發現反應II是分別以Fe、FeS為電極,以水膜為電解質溶液的電化學腐蝕,其 負
極為______;
已知:Fe(s)+S(s)=FeS(s) △H1=-2.5akJ·mol-1
S(s)+O2(g)=SO2(g) △H2=-5akJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s) △H3=-6akJ·mol-1
則反應II的熱化學方程式為_____
(4)已知H2S2O3的K1=2.2×10-1、K2=2.8×10-2。Na2S2O3水溶液呈______性,該溶液中電荷守恒式為_____ ;反應IY的反應類型為______ ;該反應______(填“能”或“不能”) 說明FeS溶解性強于FeS2O3
(5)瀘天化尿塔的最終腐蝕產物為______;為了有效防腐,北鋼建議瀘天化在生產中用 CuSO4溶液“脫硫(H2S)”,其中涉及的離子方程式為
__________________
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
I.設反應①Fe(s)+CO2(g) FeO(s)+CO(g)的平衡常數為K1。反應 ②Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常數為K1。反應 ②Fe(s)+H2O(g)  FeO(s)+H2(g)的平衡常數為K2,在不同溫度下,K1、K2的值如下:
FeO(s)+H2(g)的平衡常數為K2,在不同溫度下,K1、K2的值如下:
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
 CO(g)+H2O(g),這是一個 (填“吸”或“放”)熱反應,要使平衡③向右移動,可采取的措施有 (填序號)。
CO(g)+H2O(g),這是一個 (填“吸”或“放”)熱反應,要使平衡③向右移動,可采取的措施有 (填序號)。 FeO(s)+CO(g)在溫度T1下進行;Fe(s)+H2O(g)
FeO(s)+CO(g)在溫度T1下進行;Fe(s)+H2O(g)  FeO(s)+H2(g)在溫度T2下進行,已知T1>T2,且c(CO2)>c(H2O)(其他條件均相同),則兩者的反應速率 (填序號)。
FeO(s)+H2(g)在溫度T2下進行,已知T1>T2,且c(CO2)>c(H2O)(其他條件均相同),則兩者的反應速率 (填序號)。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
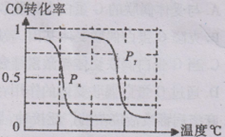
甲醇是一種很好的燃料,工業上用CH4和H2O 為原料,通過反應I和Ⅱ來制備甲醇。
⑴將1.0 mol CH4和2.0 mol H2O(g)通人反應室(容積為100L),在一定條件下發生反應:
CH4(g)+H2O(g) CO(g)+3H2(g)……I。CH4的轉化率與溫度、壓強的關系如右圖所示。
CO(g)+3H2(g)……I。CH4的轉化率與溫度、壓強的關系如右圖所示。
①已知100℃時達到平衡所需的時間為5min,則用H2表示的平均反應速率為 。
②圖中的P1_ P2(填“<”、“>”或“=”),100℃時平衡常數為 。
③該反應的△H 0(填“<”、“>”或“=”)。
(2)在一定條件下,將a mol CO與3a mol H2的混合氣體在催化劑作用下能自發反應生成甲醇: CO(g)+2H2(g) CH3OH(g) △H<0 ……Ⅱ
CH3OH(g) △H<0 ……Ⅱ
④若容器容積不變,下列措施可增加甲醇產率的是
A.升高溫度 B.將CH3OH(g)從體系中分離
C.充人He,使體系總壓強增大 D.再充人lmol CO和3 mol H2
⑤為了尋找合成甲醇的溫度和壓強的適宜條件,某同學設計了三組實驗,部分實驗條件已經填在下面實驗設計表中。
A.下表中剩余的實驗條件數據: a=_ ;b=_ 。
| 實驗編號 | T(℃) | n(CO)/n(H2) | P(Mpa) |
| 1 | 150 | 1/3 | 0.1 |
| 2 | a | 1/3 | 5 |
| 3 | 350 | b | 5 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
Cl2合成有機物時會產生副產物HC1。4HCl+O2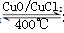 2Cl2+2H2O,可實現氯的循環利用。
2Cl2+2H2O,可實現氯的循環利用。
完成下列填空:
(1)該反應平衡常數的表達式K= ;若反應容器的容積為2L,8min后達到平衡,測得容器內物質由2.5mol減少至2.25mol,則HCl的平均反應速率為 mol/L? min。
(2)若該反應在體積不變的密閉容器中發生,當反應達平衡時,下列敘述正確的是 。
a.v (HCl)="2" v(Cl2)
b.4v正(HCl)= v逆(O2)
c.又加入1mol O2,達新平衡時,HCl的轉化率增大
d.分離出H2O,達新平衡時,v正(HCl)增大
(3)下圖是該反應兩種投料比[n (HCl):n (O2)分別為4:1和2:1 ] 下,反應溫度對HCl平衡轉化率影響的曲線。下列敘述正確的是 。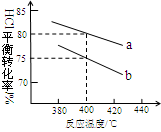
a.該反應的正反應是放熱反應
b.其他條件不變,升高溫度,平衡常數K值增大
c.若平衡常數K值變大,達新平衡前v逆始終減小
d.若平衡常數K值變大,則平衡向正反應方向移動
(4)投料比為4:1、溫度為400℃時,平衡混合物中Cl2的物質的量分數是 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
鉛及其化合物工業生產及日常生活具有非常廣泛的用途。
(1)瓦紐科夫法熔煉鉛,其相關反應的熱化學方程式如下:
2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) ΔH=" a" kJ/mol
PbS(s)+2PbO(s)=3Pb(s)+SO2(g) ΔH=" b" kJ·mol-1
PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) ΔH=" c" kJ·mol-1
反應3PbS(s) + 6O2(g) = 3PbSO4(s) ΔH="kJ" ·mol-1(用含a,b ,c的代數式表示)。
(2)還原法煉鉛,包含反應PbO(s)+CO(g)  Pb(s) + CO2(g) ΔH,該反應的平衡常數的對數值與溫度的關系如下表
Pb(s) + CO2(g) ΔH,該反應的平衡常數的對數值與溫度的關系如下表
| 溫度 | 300 | 727 | 1227 |
| lgK | 6.17 | 2.87 | 1.24 |



查看答案和解析>>
科目:高中化學 來源: 題型:問答題
(14分)研究CO2與CH4的反應使之轉化為CO和H2,對減緩燃料危機,減少溫室效應具有重要的意義。
(1)已知:①2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-802kJ·mol-1
則CH4(g)+CO2(g) 2CO(g)+2H2(g) △H= kJ·mol-1
2CO(g)+2H2(g) △H= kJ·mol-1
(2)在密閉容器中通入物質的量濃度均為0.1mol·L-1的CH4與CO2,在一定條件下發生反應CH4(g)+CO2(g) 2CO(g)+2H2(g),測得CH4的平衡轉化率與溫度、壓強的關系如下圖所示。
2CO(g)+2H2(g),測得CH4的平衡轉化率與溫度、壓強的關系如下圖所示。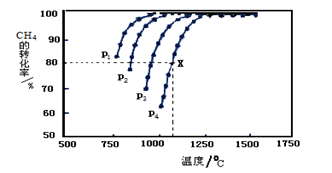
?據圖可知,P1、P2、 P3、P4由大到小的順序 。
?在壓強為P4、1100℃的條件下,該反應5min時達到平衡點X,則用CO表示該反應的速率為 。該溫度下,反應的平衡常數為 。
(3)CO和H2在工業上還可以通過反應C(s)+H2O(g)  CO(g)+H2 (g)來制取。
CO(g)+H2 (g)來制取。
①在恒溫恒容下,如果從反應物出發建立平衡,可認定平衡已達到的是
| A.體系壓強不再變化 | B.H2與CO的物質的量之比為1 :1 |
| C.混合氣體的密度保持不變 | D.氣體平均相對分子質量為15,且保持不變 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com