
(1)①現有11g由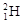 和
和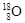 組成的水分子的物質的量 mol,其中含中子數為
mol,電子數為
個。
組成的水分子的物質的量 mol,其中含中子數為
mol,電子數為
個。
②請畫出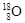 2-微粒的結構示意圖: 。
2-微粒的結構示意圖: 。
(2)質量相等的兩種物質SO2和SO3,兩種物質中硫元素質量之比為 ,分子物質的量之比為 ,所含氧原子個數之比為 。
(3)0.2L 0.5mol/L Al2(SO4)3溶液和0.5L 0.5mol/L Al2(SO4)3溶液所含SO42—離子濃度之比為____________,SO42—離子數目之比為____________。
(4)20.6g NaR 含有Na+0.2mol,則NaR的摩爾質量為 ,則含R 8.0g 的NaR的物質的量為 mol 。
(5)實驗室用二氧化錳與濃鹽酸反應制取氯氣,反應方程式如下:
MnO2+4HCl(濃)  MnCl2+2H2O+Cl2↑。若0.1 molMnO4與足量的濃鹽酸充分反應,則有
mol
HCl被氧化,轉移電子的物質的量為
mol,產生的Cl 2在標準狀況下的體積為 L 。
MnCl2+2H2O+Cl2↑。若0.1 molMnO4與足量的濃鹽酸充分反應,則有
mol
HCl被氧化,轉移電子的物質的量為
mol,產生的Cl 2在標準狀況下的體積為 L 。
(1)①0.5 6 5NA
②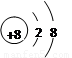
(2)5:4 5:4 5:6 (3)1:1 2:5 (4)103g/mol 0.1 (5)0.2 0.2 2.24
【解析】
試題分析:(1)①由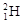 和
和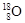 組成的水分子的摩爾質量是22g/mol,所以11g由
組成的水分子的摩爾質量是22g/mol,所以11g由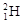 和
和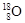 組成的水分子的物質的量=11g÷22g/mol=0.5mol。又因為質子數+中子數=質量數,所以其中含中子數為[(2-1)×2+18-8]×0.5mol=6mol。由于質子數=核外電子數,所以電子數為(1×2+8)×0.5×NA=5NA
個。
組成的水分子的物質的量=11g÷22g/mol=0.5mol。又因為質子數+中子數=質量數,所以其中含中子數為[(2-1)×2+18-8]×0.5mol=6mol。由于質子數=核外電子數,所以電子數為(1×2+8)×0.5×NA=5NA
個。
②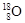 2-微粒的核外電子數是8+2=10個,所以該微粒的結構示意圖為
2-微粒的核外電子數是8+2=10個,所以該微粒的結構示意圖為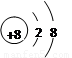 。
。
(2)質量相等的兩種物質SO2和SO3,其物質的量之比=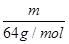 :
: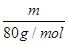 =5:4,所以兩種物質中硫元素質量之比為5:4,分子物質的量之比為5:4,所含氧原子個數之比為2×5:3×4=5:6。
=5:4,所以兩種物質中硫元素質量之比為5:4,分子物質的量之比為5:4,所含氧原子個數之比為2×5:3×4=5:6。
(3)0.2L 0.5mol/L Al2(SO4)3溶液中SO42—離子濃度是0.5mol/L×3=1.5mol/L,0.5L 0.5mol/L Al2(SO4)3溶液中SO42—離子濃度=0.5mol/L×3=1.5mol/L,因此所含SO42—離子濃度之比為1:1,SO42—離子數目之比為0.2L×1.5mol/L:0.5L×1.5mol/L=2:5。
(4)20.6g NaR 含有Na+0.2mol,則NaR的物質的量也是0.2mol,則其摩爾質量為20.6g÷0.2mol=103g/mol。這說明R的相對原子質量是103-23=80,則8.0gR的物質的量=8.0g÷80g/mol=0.1mol,所以含R 8.0g 的NaR的物質的量也是0.1 mol 。
(5)根據反應MnO2+4HCl(濃) MnCl2+2H2O+Cl2↑可知,鎂消耗1mol二氧化錳的同時消耗4mol氯化氫,生成1mol氯氣,這說明被氧化的氯化氫是2mol,所以若0.1 molMnO4與足量的濃鹽酸充分反應,則有0.2mol HCl被氧化。錳元素的化合價從+4價降低到+2價,因此轉移電子的物質的量為(4-2)×0.1mol=0.2mol,氯氣的物質的量是0.1mol,則產生的Cl 2在標準狀況下的體積為 0.1mol×22.4L/mol=2.24L。
MnCl2+2H2O+Cl2↑可知,鎂消耗1mol二氧化錳的同時消耗4mol氯化氫,生成1mol氯氣,這說明被氧化的氯化氫是2mol,所以若0.1 molMnO4與足量的濃鹽酸充分反應,則有0.2mol HCl被氧化。錳元素的化合價從+4價降低到+2價,因此轉移電子的物質的量為(4-2)×0.1mol=0.2mol,氯氣的物質的量是0.1mol,則產生的Cl 2在標準狀況下的體積為 0.1mol×22.4L/mol=2.24L。
考點:考查物質的量、物質的量濃度以及氧化還原反應的有關計算以及微粒結構示意圖的書寫


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:


查看答案和解析>>
科目:高中化學 來源: 題型:
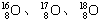 三種核素,氫元素有
三種核素,氫元素有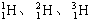 三種核素.
三種核素.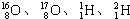 四種核數最多可以組成
四種核數最多可以組成 和
和 組成的水分子,其中含中子數為
組成的水分子,其中含中子數為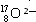 微粒的結構示意圖:
微粒的結構示意圖: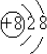
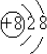
查看答案和解析>>
科目:高中化學 來源: 題型:
(6分)在自然界中許多元素有多種核素,如氧元素存在![]() 、
、![]() 、
、![]() 三種核素,氫元素有
三種核素,氫元素有![]() 、
、![]() 、
、![]() 三種核素。
三種核素。
(1)![]() 、
、![]() 、
、![]() 、
、![]() 四種核數最多可以組成 種水分子
四種核數最多可以組成 種水分子
(2)現有11g由![]() 和
和![]() 組成的水分子,其中含中子數為 mol,電子數為 個。
組成的水分子,其中含中子數為 mol,電子數為 個。
(3)請畫出![]() 2—微粒的結構示意圖: 。
2—微粒的結構示意圖: 。
查看答案和解析>>
科目:高中化學 來源:2011-2012年浙江省金華一中高一上學期期中考試化學試卷 題型:單選題
在自然界中許多元素有多種核素,如氧元素存在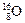 、
、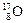 、
、 三種核素,氫元素有
三種核素,氫元素有 、
、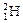 、
、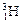 三種核素。
三種核素。
(1)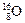 、
、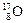 、
、 、
、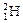 四種核數最多可以組成 種水分子。
四種核數最多可以組成 種水分子。
(2)現有11g由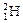 和
和 組成的水分子,其中含
組成的水分子,其中含 中子數為 mol,電子數為 個。
中子數為 mol,電子數為 個。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com