
【題目】中學化學中下列各物質間不能實現 (“→”表示一步完成)轉化的是
(“→”表示一步完成)轉化的是
選項 | A | B | C | D |
a | CH3CH2OH | CH2=CH2 | Cl2 | C |
b | CH3CHO | CH3CH2Br | HClO | CO |
c | CH3COOH | CH3CH2OH | HCl | CO2 |
A. AB. BC. CD. D
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】A、X、W、D、E為短周期元素,且原子序數依次增大。A、D同主族,X、W同周期, X形成的氣態氫化物可使濕潤的紅色石蕊試紙變藍, A、W能形成兩種液態化合物A2W和A2W2,E元素的周期序數與主族序數相等。
(1)W的原子結構示意圖為________。
(2)A、W兩種元素能形成含18電子的分子,請寫出該分子的電子式:_______________。用電子式表示化合物D2W的形成過程______________________。
(3)下列事實能說明W元素的非金屬性比S元素的非金屬性強的是________ (填字母)。
a.W單質與H2S溶液反應,溶液變渾濁
b.在氧化還原反應中,1 mol W單質比1 mol S得電子多
c.W和S兩元素的簡單氫化物受熱分解,前者的分解溫度高
(4)X的最高價氧化物對應水化物與其簡單氣態氫化物所形成的化合物中含有的化學鍵類型是_______
(5)廢印刷電路板上含有銅,以往的回收方法是將其灼燒使銅轉化為氧化銅,再用硫酸溶解。現在改用A2W2和稀硫酸浸泡廢印刷電路板既達到上述目的,又保護了環境,試寫出反應的離子方程式________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將一定質量的鐵、氧化鐵、氧化銅的混合物粉末放入100mL 4.40 mol/L鹽酸中,充分反應后產生896 mL H2(標準狀況),殘留固體1.28g。過濾,濾液中無Cu2+。將濾液加水稀釋到200mL,測得其中c(H+)為0.400mol/L。則原混合物中單質鐵的質量是 ( )
A. 2.24g B. 3.36g C. 5.60g D. 10.08g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于圖中裝置說法正確的是

A. 裝置中電流移動的途徑:正極→Fe→M溶液→石墨→正極
B. 若M為滴加酚酞的NaCl溶液,通電一段時間后,鐵電極附近溶液顯紅色
C. 若M為CuSO4溶液,可以實現石墨上鍍銅
D. 若將電源反接,M為NaCl溶液,可以用于制備Fe(OH)2并可以使其較長時間保持白色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關能量的說法不正確的是 ( )
A. 化石能源物質內部貯存著大量的能量
B. 植物的光合作用使太陽能轉化為化學能
C. 燃料燃燒時只是將化學能轉化為熱能
D.由石墨制金剛石是吸熱反應,故石墨能量比金剛石能量低
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,a、b、c、d、e為元素周期表中前4周期的一部分元素,下列有關敘述正確的是( )
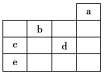
A. 元素b位于第ⅥA族,有+6、-2價兩種常見化合價
B. 五種元素中,元素e的性質最穩定
C. 元素c和d的最高價氧化物對應的水化物的酸性:c>d
D. 元素c和e的氣態氫化物的穩定性:c>e
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有下列幾組物質,請將序號填入下列空格內:
A、CH2=CH﹣COOH和油酸(C17H33COOH)
B、12C60和石墨
C、![]() 和
和![]()
D、35Cl和37Cl
E、乙醇和乙二醇
(1)互為同位素的是 ;
(2)互為同系物的是 ;
(3)互為同素異形體的是 ;
(4)互為同分異構體的是 ;
(5)既不是同系物,又不是同分異體,也不是同素異形體,但可看成是同一類物質的是 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨的合成對國家工業發展有著舉足輕重的作用,請根據化學原理知識回答下列問題:
(1)已知氫氣的燃燒熱為285.8kJ/mol。
4NH3 (g) +5O2 (g) ![]() 4NO(g) + 6H2O(l) △H= —1168.8kJ/mol
4NO(g) + 6H2O(l) △H= —1168.8kJ/mol
N2(g)+ O2(g)═ 2NO(g)△H = +180.6kJ/mol。
則工業合成氨的熱化學方程式為________________。
(2)某科研小組研究:在其他條件不變的情況下,改變起始物氫氣的物質的量對N2(g)+3H2(g) 2NH3(g)反應的影響。實驗結果如圖所示:(圖中 T表示溫度, n表示物質的量)

①圖像中 T2和 T1的關系是: T2 _______________ T1(填“高于”、“低于”、 “等于”或“無法確定”)。
②比較在a、b、c三點所處的平衡狀態中,反應物N 2 的轉化率最高的是_______________(填字母)。
③在起始體系中n(N2):n(H2)= 1:3時,反應后氨的百分含量最大;若容器容積為1L, n=3mol反應達到平衡時H2的轉化率為60%,則此條件下( T 2),反應的平衡常數 K=__________________。
(3)氮元素的+4價氧化物有兩種,它們之間發生反應:2NO2![]() N2O4 H < 0,將一定量的NO2充入注射器中后封口,下圖是在拉伸和壓縮注射器的過程中氣體透光率隨時間的變化 (氣體顏色越深,透光率越小)。下列說法正確的是______________
N2O4 H < 0,將一定量的NO2充入注射器中后封口,下圖是在拉伸和壓縮注射器的過程中氣體透光率隨時間的變化 (氣體顏色越深,透光率越小)。下列說法正確的是______________

A.b點的操作是壓縮注射器
B.c點與a點相比, c(NO2)增大, c(N2O4)減小
C.若不忽略體系溫度變化,且沒有能量損失,則b、c兩點的平衡常數Kb>Kc
D.d點:v(正)> v(逆)
(4)利用反應6NO2+8NH3=7N2+12H2O構成原電池,能消除氮氧化物的排放,減輕環境污染,裝置如圖所示。

①電極a為___________________極,其電極反應式為__________________。
②當有0.1 mol NO2被處理時,轉移電子為________________mol。
③為使電池持續放電,該離子交換膜需選用___________________交換膜。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com