
【題目】有一固體混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合而成,為檢驗它們,做了以下實驗:
①將固體混合物溶于水中,攪拌后得無色透明溶液;
②往此溶液中滴加硝酸鋇溶液,有白色沉淀產生;
③過濾,將沉淀物置于稀硝酸中,發現沉淀全部溶解。
根據上述實驗事實,回答下列問題:
(1)原固體混合物中一定含有的物質是________,一定不含有的物質是________,可能含有的物質是________(以上空格均填寫化學式)。對可能含有的物質,可采用向濾液中滴加___________________溶液的方法來檢驗。
(2)寫出步驟③中的離子方程式__________________________________________________。
【答案】 Na2CO3 Na2SO4、CuSO4、CaCl2 NaCl 硝酸酸化的硝酸銀 BaCO3+2H+![]() Ba2++CO2↑+H2O
Ba2++CO2↑+H2O
【解析】
試題(1)①溶于水后,得到無色溶液,說明不含CuSO4,因為Cu2+顯藍色,②加入硝酸鋇溶液,有白色沉淀,可能是BaSO4,也可能是BaCO3,也可能是它們的混合物,③加入硝酸,沉淀全部溶解,說明沉淀是BaCO3,混合物中含有Na2CO3,一定不含Na2SO4,因為BaSO4不溶于硝酸,總上所述混合物中一定含有混合物是Na2CO3,一定不含有的物質是Na2SO4、CuSO4,可能含有的物質是NaCl,AgCl不溶于硝酸,可以采用加入硝酸,然后再加硝酸銀溶液,如果有沉淀產生,說明含有NaCl;(2)反應化學方程式為BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑,難溶物、水、氣體不能拆,因此離子反應方程式為:BaCO3+2H+=Ba2++H2O+CO2↑。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】2017年10月27日,世界工生組織國際癌癥研究機構將三氯乙醛劃為2A類致癌物,但它可用于生產氯霉素、合霉素等。某探究小組模擬備三氯乙醛自實驗裝置如圖所示(夾持、加熱裝置均略去)。

已知:C2H5OH+4Cl2=CCl3CHO+5HCl,副反應是C2H5OH+HCl=C2H5Cl+H20。
容下列問題:
(1)寫出裝置A中發生反應的化學方程式:__________________。
(2)儀器b中冷凝水從________(填“p”或“q”,下同)口進,______口出。
(3)進入裝置D的是純凈、干燥的Cl2,則裝置B中的試劑為_____,裝置C中的試劑為____。若撤去裝置B,對實驗的影響是____________________。
(4)實驗時發現D中導管口處氣泡速率過快,合理的解決方法是__________________。
(5)已知:CCl3CHO +OH-=CHCl3+HC00-; HC00-+I2=H++2I-+CO2↑ I2+2S2O32-=2I-+S4O62-
稱取0.40g產品,配成待測溶液,加入20.00mL0.100mol/L碘標準溶液,再加入適量Na2C03溶液,反應完全后,加鹽酸調節溶液的pH,并立即用0.020mol/L的Na2S2O3溶液滴定至終點。重復上述操作3次,平均消耗Na2S2O3溶液20.00mL。滴定時所用指示劑是_______,達到滴定終點的現象是______,測得產品的純度為____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖為實驗室制取自來水的裝置示意圖,根據圖示回答下列問題。
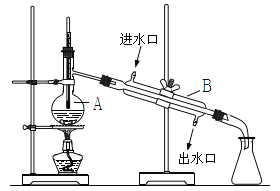
(1)圖中的兩處明顯的錯誤是____________________、_____________________。
(2)A儀器的名稱是______________,B儀器的名稱是_______________。
(3)實驗時A中除加入少量自來水外,還需加入少量___________,其作用是_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某種溶液可能含有下列陰離子中的一種或幾種:![]() 、
、![]() 、Cl。
、Cl。
(1)當溶液中有大量H+存在時,則不可能有________存在。
(2)當溶液中有大量Ba2+存在時,溶液中不可能有________存在。
(3)當溶液中有________和________等陽離子存在時,上述所有陰離子都不可能存在。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種從含Br-廢水中提取Br2的過程,包括過濾、氧化、正十二烷萃取及蒸餾等步驟。已知:
Br2 | CCl4 | 正十二烷 | |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸點/℃ | 58.76 | 76.8 | 215~217 |
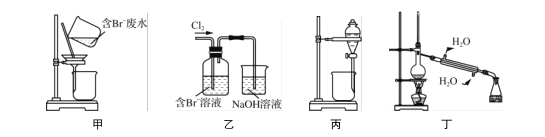
下列說法正確的是( )
A. 用甲裝置過濾時,需不斷攪拌
B. 用乙裝置將Br-氧化為Br2
C. 丙裝置中用正十二烷而不用CCl4,是因為其密度小
D. 可用裝置丁進行蒸餾,先收集正十二烷再收集Br2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:4FeO42-+10H2O=4Fe(OH)3↓+8OH-+3O2↑ ,測得c(FeO42-)在不同條件下變化如圖甲、乙、丙、丁所示:

下列說法正確的是
A. 圖甲表明,其他條件相同時,溫度越低FeO42-轉化速率越快
B. 圖乙表明,其他條件相同時,堿性越強FeO42-轉化速率越快
C. 圖丙表明,其他條件相同時,鈉鹽都是FeO42-優良的穩定劑
D. 圖丁表明,其他條件相同時,堿性條件下Fe3+能加快FeO42-的轉化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Mg-H2O2電池可用于驅動無人駕駛的潛航器。該電池以海水為電解質溶液,示意圖如下。該電池工作時,下列說法正確的是( )
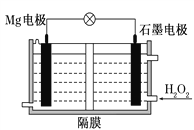
A. Mg電極是該電池的正極
B. H2O2在石墨電極上發生氧化反應
C. 石墨電極附近溶液的pH增大
D. 電子從石墨電極移向Mg電極
查看答案和解析>>
科目:高中化學 來源: 題型:
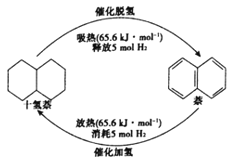
【題目】十氫奈是具有高儲氫密度的氫能載體,經歷“十氫奈(C10H18 )→四氫奈(C10H12)→奈(C10H8)”的脫氫過程釋放氫氣。已知:
C10H18(l)![]() C10H12(l)+3H2(g) △H1
C10H12(l)+3H2(g) △H1
C10H12(l)![]() C10H8(l)+2H2(g) △H2
C10H8(l)+2H2(g) △H2
△H1>△H2>0;C10H18→C10H12的活化能為Ea1,C10H12→C10H8的活化能為Ea2,十氫奈的常壓沸點為192℃;在192℃,液態十氫奈的脫氫反應的平衡轉化率約為9%。請回答:
(1)每1mol 十氫萘液體可儲存5mol氫氣,可運載到使用氫氣的場所,在催化劑的作用下釋放氫氣,生成的液體萘可重復催化加氫來儲存氫氣,如圖所示,則△H1+△H2=__________。
(2)有利于提高上述反應平衡轉化率的條件是__________。
A.高溫高壓 B.低溫低壓 C.高溫低壓 D.低溫高壓
(3)不同壓力和溫度下十氫萘的平衡轉化率如圖所示,結合圖示回答問題:
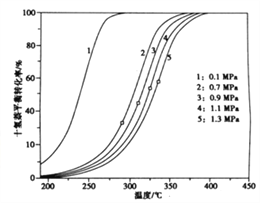
①在相同壓強下升高溫度,未達新平衡前,v正__________v逆(填寫“大于”“小于”或“等于”)。
②研究表明,將適量的十氫奈置于恒容密閉反應器中,既升高溫度又增大壓強,十氫萘的轉化率也升高,可能理由是______________________________________。
(4)溫度335℃,在恒容密閉反應器中進行高壓液態十氫奈(1.00 mol)催化脫氫實驗,測得液態C10H12和液態C10H8的產率x1和x2(以物質的量分數計)隨時間變化關系,如圖所示。
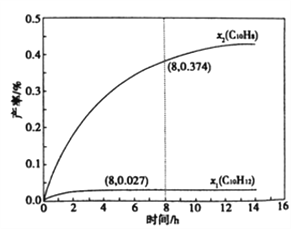
①在8h時,反應體系內氫氣的量為_______mol(忽略其他副反應),液態十氫奈的轉化率是____。
②x1顯著低于x2的原因是_______________________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com