
【題目】已知: ①亞硝酸鈉(NaNO2)是一種食品添加劑,為無色、無氣味的同體,具有防腐和抗氧化作用。②AgNO2是一種微溶于水、易溶于酸的淺黃色固體。
I.問題探究
(1)人體正常的血紅蛋白中應含Fe2+,誤食亞硝酸鹽(如NaNO2)會致使機體組織缺氧,出現青紫而中毒,原因是___________。若發生中毒時,你認為下列物質有助于解毒的是____(填字母)。
A.牛奶 B.Mg(OH)2 C.維生素C D.小蘇打
(2)由于亞硝酸鈉和食鹽性狀相似,曾多次發生過將NaNO2誤當食鹽食用的事件。要區別NaNO2和NaCl兩種固體,你需用的試劑是_______________。
II.實驗測定
為了測定某樣品中NaNO2的含量,某同學進行如下實驗:
①稱取樣品ag,加水溶解,配制成100mL溶液。
②取25.00mL溶液于錐形瓶中,用0.0200mol/LKMnO4標準溶液(酸性)進行滴定,滴定結束后消耗KMnO4溶液VmL。
(1)上述實驗①所需玻璃儀器除玻璃棒、膠頭滴管之外還有________。
(2)在進行滴定操作時,KMnO4溶液盛裝在______(填“酸式”或“堿式”)滴定管中。當滴入最后一滴溶液,________時達到滴定終點。
(3)滴定過程中發生反應的離子方程式是________;測得該樣品中NaNO2的質量分數為_____。
(4)若滴定管未用KMnO4標準溶液潤洗就直接注入,則測定結果______(填“偏大”、“偏小”或“無影響”,下同);若滴定過程中剛出現顏色變化就停止滴定,則測定結果________。
【答案】 血紅蛋白中Fe2+被NO2氧化為Fe3+,導致血紅蛋白失去運氧功能 C AgNO3溶液 燒杯、100mL容量瓶 酸式 錐形瓶中無色溶液變成粉紅色,且30s內不褪色 5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O ![]() 偏大 偏小
偏大 偏小
【解析】I.(1)若發生中毒時,血紅蛋白中Fe2+被NO-2氧化為Fe3+,導致血紅蛋白失去載氧功能,致使機體組織缺氧;能夠解毒的物質即為能夠代替![]() 被氧化的物質,題給的牛奶、Mg(OH)2、小蘇打都不具有還原性,無法解毒,維生素C具有還原性,可以起到解毒的作用,C正確;正確答案:血紅蛋白中Fe2+被NO2氧化為Fe3+,導致血紅蛋白失去運氧功能; C 。
被氧化的物質,題給的牛奶、Mg(OH)2、小蘇打都不具有還原性,無法解毒,維生素C具有還原性,可以起到解毒的作用,C正確;正確答案:血紅蛋白中Fe2+被NO2氧化為Fe3+,導致血紅蛋白失去運氧功能; C 。
(2)向由NaCl固體配制的溶液中加入HNO3酸化的AgNO3,生成不溶于HNO3的AgCl沉淀,向 NaNO2固體配制的溶液中加入AgNO3,生成不溶于水的AgNO2淺黃色固體,再加入HNO3后沉淀溶解,可以區分兩種固體;正確答案:AgNO3溶液。
II.(1)根據題給儀器外,配制100mL一定物質的量濃度的溶液還需要的玻璃儀器有燒杯、100mL容量瓶;正確答案:燒杯、100mL容量瓶。
(2)酸性 KMnO4溶液具有強氧化性,腐蝕橡膠,因此應該盛裝在酸式滴定管中;KMnO4與NaNO2溶液反應,KMnO4被還原為無色的錳離子,當錐形瓶中無色溶液變成粉紅色,且30s內不褪色時,說明滴定達到終點;正確答案:燒杯、100mL容量瓶;酸式;錐形瓶中無色溶液變成粉紅色,且30s內不褪色 。
(3)KMnO4與NaNO2溶液反應,KMnO4被還原為無色的錳離子,亞硝酸根離子被氧化為硝酸根離子,反應的離子方程式是5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O;根據反應關系:5NO2----2MnO4-可知:n(NaNO2)=n(NO2-)=0.0200×VmL×10-3 ×5/2mol;100mL溶液中含有n(NaNO2)= 0.0200×VmL×10-3 ×5/2×100/25 mol, NaNO2的質量為0.0200×VmL×10-3 ×5/2×100/25×69g=1.38V×10-2 g,該樣品中NaNO2的質量分數為1.38V×10-2/a×100%=![]() ;正確答案:5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O;
;正確答案:5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O; ![]() 。
。
(6)若滴定管未用 KMnO4標準溶液潤洗就直接注入,將導致KMnO4的濃度減小,使消耗的 KMnO4標準溶液體積V增大,根據質量分數公式ω(NaNO2)=![]() 可知,測定結果偏大;若測定過程中剛出現顏色變化就停止滴定,NaNO2還未反應完全,使得V減小,根據質量分數公式ω(NaNO2)=
可知,測定結果偏大;若測定過程中剛出現顏色變化就停止滴定,NaNO2還未反應完全,使得V減小,根據質量分數公式ω(NaNO2)=![]() 可知,測定結果偏小;正確答案:偏大; 偏小。
可知,測定結果偏小;正確答案:偏大; 偏小。


 一線名師口算應用題天天練一本全系列答案
一線名師口算應用題天天練一本全系列答案 小學學習好幫手系列答案
小學學習好幫手系列答案科目:高中化學 來源: 題型:
【題目】某興趣小組利用電解裝置,探究“鐵作陽極”時發生反應的多樣性,實驗過程如下。
I.KCl作電解質
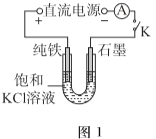
(1)一定電壓下,按圖-1裝置電解,現象如下:
石墨電極上迅速產生無色氣體,鐵電極上無氣體生成,鐵逐漸溶解。
5min后U型管下部出現灰綠色固體,之后鐵電極附近也出現灰綠色固體,10min后斷開K。按圖-2進行實驗。
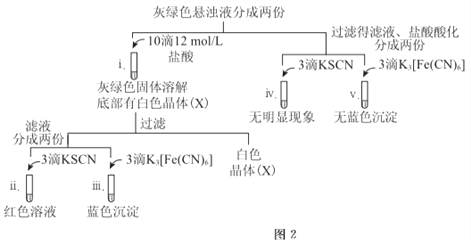
①石墨電極上的電極反應式是________。
②確認灰綠色固體中含有Fe2+的實驗現象是_______。
③灼燒晶體X,透過藍色鈷玻璃觀察到火焰呈紫色。結合平衡移動原理,解釋“試管i中析出白色晶體”的原因是_______。
(2)其他條件不變時,用圖-3裝置重復實驗,10min后鐵電極附近溶液依然澄清,斷開K。按圖-4進行實驗
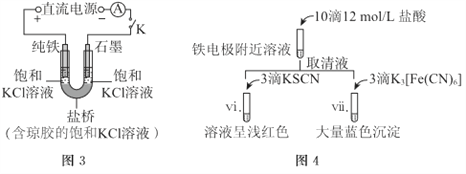
①鹽橋的作用是_______。
②與實驗I中vi、vii與ii~v中的現象比較,可以得出的結論是(答兩點):_______。
II.KOH作電解質
(3)用圖-1裝置電解濃KOH溶液,觀察到鐵電極上立即有氣體生成,附近溶液逐漸變為淡紫色(![]() ),沒有沉淀產生。
),沒有沉淀產生。
①鐵電極上OH-能夠放電的原因是______。
②陽極生成![]() 的總電極反應式是______。
的總電極反應式是______。
③某同學推測生成![]() 的必要條件是濃堿環境,將圖-5中的實驗方案補充完整,證實推測成立。
的必要條件是濃堿環境,將圖-5中的實驗方案補充完整,證實推測成立。
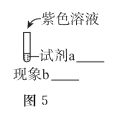 ______
______
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將2.3g鈉放入97.7g水中,下列說法正確的是
A. 電子轉移的數目為2NA
B. 所得溶液的質量分數是等于4%
C. 產生氣體的體積為1.12L
D. 產生的氣體含有0.1mol的電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】若以E(nl)表示某能級的能量,以下各式中正確的是( )
A. E(3s)>E(2s)>E(1s) B. E(3s)>E(3p)>E(3d)
C. E(4f)>E(4s)>E(3d) D. E(5s)>E(4s)>E(4f)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】含汞廢水主要來源于氯堿工業和塑料工業,未經處理不得排放。某含汞酸性廢水(主要含Hg2+、H+、Na+、Cl-等)的處理工藝流程如下圖所示:

請回答:
(1)含汞廢水未經處理直接排放的危害是_________(填字母)
a.造成水體污染 b. 引起人體中毒
(2)調節pH時加入的溶液A可能是__________(填字母)
a. 鹽酸 b. NaOH溶液
(3)圖示所用到的廢水處理方法為_____________,其中Na2S與Hg2+發生反應的離子方程式為________________________________________。
(4)該廢水經處理后,測得有關數據如下(其他離子忽略不計):
離子 | Na+ | Fe2+ | Cl- | SO42- |
濃度(mol/L) | 3.0×10-4 | c | 2.0×10-4 | 2.5×10-4 |
則c(Fe2+) = ______________mol/L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于共價鍵的說法,正確的是
A.分子內部一定會存在共價鍵
B.由非金屬元素組成的化合物內部一定全是共價鍵
C.非極性鍵只存在于雙原子單質分子中
D.離子化合物的內部可能存在共價鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于元素周期表敘述不正確的是
A.短周期為第1、2、3周期
B.ⅠA族都是金屬元素
C.元素周期表中有7個主族
D.可根據元素在周期表中位置預測其性質
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,兩個連通容器用活塞分開,左右兩室體積相同,左室充入一定里NO,右室充入一定量O2,且恰好使兩容器內氣體密度相同。打開活塞,使NO與O2充分反應,下列判斷正確的是(不考慮NO2轉化為N2O4) ( )
![]()
A.反應前后左室的壓強相同
B.開始時左右兩室中的分子數相同
C.反應后容器內的密度與反應前的相同
D.反應后容器內無O2存在
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖中兩條曲線分別表示1g C3H6氣體、1g M氣體在相同體積的容器中壓強和溫度的關系,試根據圖判斷M氣體可能是

A.PH3 B.N2 C.C3H4 D.N2O
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com