
【題目】a、b、c、d、e為原子序數依次增大的五種常見短周期元素,可組成一種化合物A,其化學式為ba4d(ec4)2。A能夠發生如下轉化關系:

己知C的分子式為ba3,能使濕潤的紅色石蕊試紙變藍。則下列說法正確的是
A.原子半徑b>c
B.e的氧化物的水化物為強酸
C.化合物A為共價化合物
D.元素非金屬性強弱c<e
【答案】A
【解析】
A和氫氧化鈉溶液反應生成B和C,C為氣體,C的分子式為ba3,能使濕潤的紅色石蕊試紙變藍,根據化學式可推斷C為氨氣,B為白色沉淀,繼續加入氫氧化鈉溶液沉淀溶解,則B可推斷為氫氧化鋁,A中加入酸化的氯化鋇溶液形成白色沉淀,則A中含有硫酸根離子,根據以上推斷,A為NH4Al(SO4)2,a為H元素,b為N元素,c為O元素,d為Al元素,e為S元素,據此分析解答。
A.b為N元素,c為O元素,同周期元素隨核電荷數增大,半徑逐漸減小,則原子半徑b>c,故A正確;
B.e為S元素,S的氧化物的水化物有硫酸和亞硫酸,亞硫酸是弱酸,故B錯誤;
C.A為NH4Al(SO4)2,是離子化合物,故C錯誤;
D.c為O元素,e為S元素,同主族元素隨核電荷數增大非金屬性逐漸減弱,元素非金屬性強弱c>e,故D錯誤;
答案選A。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】N2O5在一定溫度下可發生反應:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0。T1溫度時,向密閉容器中通入N2O5氣體,部分實驗數據見下表:
4NO2(g)+O2(g) ΔH>0。T1溫度時,向密閉容器中通入N2O5氣體,部分實驗數據見下表:
時間/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/(mol·L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
下列說法正確的是( )
A.500s內NO2的生成速率為2.96×10-3mol/(L·s)
B.T1溫度下該反應平衡時N2O5的轉化率為29.6%
C.平衡后,其他條件不變,將容器體積變為原來的![]() ,則c(N2O5)<5.00mol/L
,則c(N2O5)<5.00mol/L
D.T1、T2溫度下的平衡常數分別為K1、K2,若T1>T2,則K1>K2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃,向20 mL 0.1 mol·L-1 H2A溶液中滴加0.1 mol·L-1的NaOH溶液,有關粒子物質的量的變化如圖所示。下列說法正確的是

A.II表示微粒A2-的物質的量的變化曲線
B.H2A在水中的第一步電離方程式為H2A![]() A2-+2H+
A2-+2H+
C.![]() 的值隨著V[NaOH(aq)]的增大而減小
的值隨著V[NaOH(aq)]的增大而減小
D.V[NaOH(aq)]=20 mL時,溶液中存在關系:c(HA-)+c(A2-)+c(H2A)=0.1 mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】明代《天工開物》記載“火法”冶煉鋅: “爐甘石十斤,裝載入一泥罐內,…然后逐層用煤炭餅墊盛,其底鋪薪,發火煅紅,…冷淀,毀罐取出,…,即倭鉛也”(注:爐甘石的主要成分為碳酸鋅,泥罐中摻有煤炭)。下列說法不正確的是
A. 倭鉛是指金屬鋅和鉛的混合物
B. 煤炭中起作用的主要成分是C
C. 冶煉Zn的反應方程式為:ZnCO3+2C![]() Zn+3CO↑
Zn+3CO↑
D. 該冶煉鋅的方法屬于熱還原法
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物M、N分子的模型如圖所示,其中不同顏色的球表示不同的原子,原子之間的化學鍵可以是單鍵、雙鍵。下列說法錯誤的是
M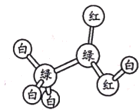 N
N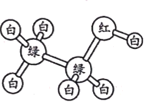
A.M與HCOOCH3互為同分異構體
B.N的官能團為羥基
C.在與鈉的反應中N放出氣泡比M快
D.N能使酸性高錳酸鉀溶液褪色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于熱化學反應的描述中正確的是
A.HCl和NaOH反應的中和熱△//=-57.3kJ/mol,則H2SO4和Ca(OH)2反應的中和熱△=2×(-57.3)kJ/mol
B.需要加熱才能發生的反應一定是吸熱反應
C.CO(g)的燃燒熱是283.0kJ/mol,則2CO2(g)=2CO(g)+O2(g)反應的△H=+2×283.0kJ/mo1
D.1 mol甲烷燃燒生成氣態水和二氧化碳所放出的熱量是甲烷的燃燒熱
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.H2(g)+I2(g)![]() 2HI(g),其他條件不變,縮小反應容器體積,正逆反應速率不變
2HI(g),其他條件不變,縮小反應容器體積,正逆反應速率不變
B.C(s)+H2O(g)![]() H(g)+CO(g),碳的質量不再改變說明反應已達平衡
H(g)+CO(g),碳的質量不再改變說明反應已達平衡
C.若在恒溫恒容容器內,壓強不再隨時間變化能說明反應2A(?)+B(g)![]() 2C(?)已達平衡,則A、C不能同時是氣體
2C(?)已達平衡,則A、C不能同時是氣體
D.1 mol N2和3 mol H2反應達到平衡時H2轉化率為10%,放出的熱量為Q1;在相同溫度和壓強下,當2 mol NH3分解為N2和H2的轉化率為10%時,吸收的熱量為Q2,Q2不等于Q1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】T℃時,將2.0molA(g)和2.0molB(g)充入體積為1L的密閉容器中,在一定條件發生下述反應:A(g)+B(g)![]() 2C(g)+D(s) △H<0;t時刻反應達到平衡時,C(g)為2.0mol。下列說法正確的是( )
2C(g)+D(s) △H<0;t時刻反應達到平衡時,C(g)為2.0mol。下列說法正確的是( )
A.t時刻反應達到平衡時,A(g)的體積分數為20%
B.T℃時該反應的化學平衡常數K=2
C.t時刻反應達到平衡后,縮小容器體積,平衡逆向移動
D.T℃時,若將A(g)、B(g)各1.0mol充入同樣容器,平衡后,a(A)為50%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】H2C2O4(草酸)為二元弱酸,在水溶液中H2C2O4、HC2O4-和C2O42-物質的量分數與pH關系如圖所示,下列說法不正確的是
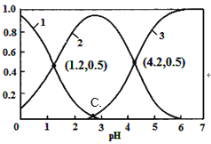
A.根據圖中數據計算可得C點溶液pH為2.7
B.向草酸溶液中滴加氫氧化鈉溶液至pH為4.2時c(Na+)+c(H+)=3c(C2 O42-)+c(OH-)
C.0.1 mol·L-1NaHC2O4溶液中c(Na+)>c(HC2O4-)>c(H+)>c(OH-)
D.當混合溶液呈中性時,c(Na+)>c(HC2O4-)> c(C2 O42-) >c(H+)=c(OH-)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com