
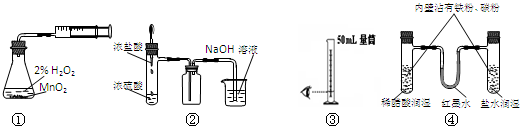
| A.裝置①測定化學反應速率 | B.裝置②制取并吸收HCl |
| C.裝置③量取8.5mL的稀硫酸 | D.裝置④模擬鐵的腐蝕 |
科目:高中化學 來源:不詳 題型:實驗題
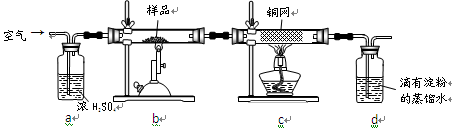
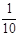 置于錐形瓶中,用0.05mol/L標準碘溶液進行滴定,初讀數為0.10mL,末讀數如右圖所示。
置于錐形瓶中,用0.05mol/L標準碘溶液進行滴定,初讀數為0.10mL,末讀數如右圖所示。

查看答案和解析>>
科目:高中化學 來源:不詳 題型:實驗題
 5NaC1+NaC1O3+3H2O,今在—5℃的NaOH溶液中通入適量C12(平衡常數K=1.09×1012),此時C12的氧化產物主要是 ;將溶液加熱,溶液中主要離子濃度隨溫度的變化如右圖所示,圖中A、B、C依次表示的離子是 。
5NaC1+NaC1O3+3H2O,今在—5℃的NaOH溶液中通入適量C12(平衡常數K=1.09×1012),此時C12的氧化產物主要是 ;將溶液加熱,溶液中主要離子濃度隨溫度的變化如右圖所示,圖中A、B、C依次表示的離子是 。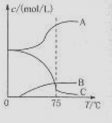
 NaC1O3+3H2↑
NaC1O3+3H2↑ HC1O+H++C1— HC1O
HC1O+H++C1— HC1O H++C1O—
H++C1O—
查看答案和解析>>
科目:高中化學 來源:不詳 題型:實驗題
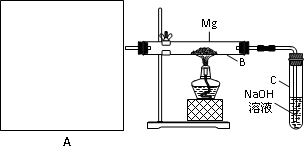
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題

查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.10 | B.50 | C.5×103 | D.104 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
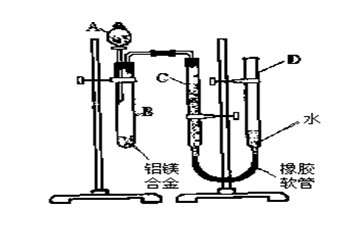
查看答案和解析>>
科目:高中化學 來源:不詳 題型:實驗題
 NaOH溶液吸收過量的CO2氣體,至CO2
NaOH溶液吸收過量的CO2氣體,至CO2 氣體不再溶解;
氣體不再溶解;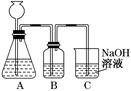
 的試劑是_____
的試劑是_____  _,作用是_____________________________________________
_,作用是_____________________________________________查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com