
【題目】紅礬鈉(重鉻酸鈉:Na2Cr2O7·2H2O)是重要的基本化工原料,在印染工業、電鍍工業和皮革工業中作助劑,在化學工業和制藥工業中也用作氧化劑,應用領域十分廣泛。
實驗室中紅礬鈉可用鉻鐵礦(主要成分:FeO·Cr2O3)利用以下過程來制取。
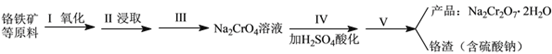
(1)步驟I中反應的化學方程式為:4FeO·Cr2O3(s)+8Na2CO3(s)+7O2 (g)![]() 8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) △H<0該反應的化學平衡常數的表達式為__________________________。
8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) △H<0該反應的化學平衡常數的表達式為__________________________。
(2)在常溫下該反應速度極慢,下列措施中能使反應速率增大的是_____________________________ 。
a.升高溫度 b.及時轉移生成CO2 c.將原料粉碎 d.增加純堿的用量
(3)步驟Ⅱ中所得溶液顯堿性,其中除含有Na2CrO4外還含有鋁、硅元素的化合物,它們的化學式可能是__________________________、____________________________。
(4)步驟Ⅲ需將溶液的pH調至7~8并煮沸,其目的是_____________________________________。
(5)步驟Ⅳ酸化時,CrO42-轉化為Cr2O72-,寫出平衡轉化的離子方程式:_________________。
【答案】 K = c8(CO2)/c7 (O2) a c NaA1O2 Na2SiO3 除去A1O2-、SiO32-等雜質 2CrO42-+2H+= Cr2O72-+H2O
【解析】(1). 在4FeO·Cr2O3(s)+8Na2CO3(s)+7O2 (g)![]() 8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) 中,FeO·Cr2O3、Na2CO3、Na2CrO4、Fe2O3為固體,則該反應的化學平衡常數表達式為: K = c8(CO2)/c 7 (O2),故答案為: K = c8(CO2)/c 7 (O2);
8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) 中,FeO·Cr2O3、Na2CO3、Na2CrO4、Fe2O3為固體,則該反應的化學平衡常數表達式為: K = c8(CO2)/c 7 (O2),故答案為: K = c8(CO2)/c 7 (O2);
(2). a. 升高溫度,可以加快反應速率,故a正確;b. 及時轉移生成的CO2,CO2的濃度減小,反應速率減慢,故b錯誤;c. 將原料粉碎,可以增大固體的接觸面積,加快反應速率,故c正確;d. 因純堿是固體,所以增加純堿的用量,不能改變反應速率,故d錯誤;答案選ac;
(3). 鉻鐵礦的主要成分是FeO·Cr2O3,還含有Al2O3、SiO2等雜質,步驟Ⅱ中所得溶液顯堿性,為了不引入新的雜質,說明步驟II中加入的物質是氫氧化鈉,Al2O3、SiO2能和氫氧化鈉反應分別生成偏鋁酸鈉和硅酸鈉,故答案為:NaA1O2;Na2SiO3;
(4). 步驟Ⅲ需將溶液的pH調至7~8并煮沸,A1O2-、SiO32-等雜質可以生成沉淀而除去,故答案為:除去A1O2-、SiO32-等雜質;
(5). 步驟IV酸化時,CrO42-轉化為Cr2O72-,該反應的離子方程式為:2CrO42-+2H+= Cr2O72-+H2O,故答案為:2CrO42-+2H+= Cr2O72-+H2O。


科目:高中化學 來源: 題型:
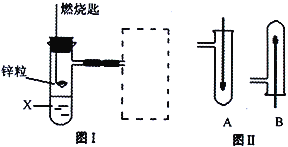
【題目】(1)圖Ⅰ是實驗室用H2還原CuO實驗的簡易裝置,其中的銅質燃燒匙可以在試管中上下移動,虛線框中需從圖Ⅱ中選取裝置。圖Ⅱ中的細銅絲一端被彎成螺旋狀,實驗時,先在酒精燈火焰上加熱,變黑后再迅速伸入制得的H2中。
①在圖Ⅰ中,X溶液應選用______。
A.稀硫酸 B.濃硫酸 C.NaCl溶液
②在圖Ⅰ虛線框中,應選用圖Ⅱ中的_______(填A或B)裝置。
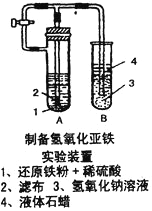
(2)某學生設計了一個制取氫氧化亞鐵的實驗方案,實驗裝置見上右圖,請分析實驗過程:
①在B試管中加入NaOH溶液后加熱煮沸l-2分鐘并立即加入2mL液體石蠟,上述操作中加熱煮沸的目的是:_____________________________。
②在具支試管A中加入稀H2SO4溶液和略微過量的鐵粉,分析為什么鐵粉要過量_____________。
③連接好導管,同時打開活栓,當鐵粉與稀硫酸反應平穩時,關閉活栓,這時看到A試管中_________(填現象),B試管中_________(填現象)。
④如果B中產生的氫氧化亞鐵遇到空氣,出現的現象是_______________,發生變化的化學方程式為_____________。
(3)現有混有少量SO2雜質的CO2氣體,請選用適當的實驗裝置,收集純凈干燥的CO2氣體。
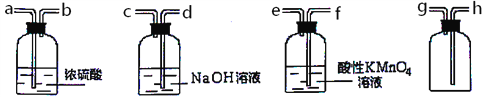
①要達到實驗目的,按氣流從左到右,各接口連接順序正確的是_______。
A.dcabh B.feabh C.feabg
②本實驗除去SO2的原理是利用SO2的________性質(填序號)。
A.氧化性 B.漂白性 C.還原性 D.酸性
③SO2與酸性高錳酸鉀反應的離子方程式是__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】寫出下列離子方程式對應的一個化學方程式:
(1)2H+ + CO32— = H2O + CO2↑ (2) 2OH-+ Cu2+ = Cu(OH)2↓
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗操作中錯誤的是
A. 做“氫氣還原氧化銅”實驗時,應先通氫氣再加熱
B. 蒸餾時燒瓶中一般要放入碎瓷片防止暴沸
C. 分液操作時,分液漏斗中下層液體從下口放出,上層液體從上口倒出
D. 開始蒸餾時,應該先加熱,再開冷凝水;蒸餾完畢,應該先關冷凝水再撤酒精燈
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】熱激活電池可用作火箭、導彈的工作電源.一種熱激活電池的基本結構如圖所示,其中作為電解質的無水LiCl﹣KCl混合物受熱熔融后,電池即可瞬間輸出電能.該電池總反應為:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有關說法正確的是( ) 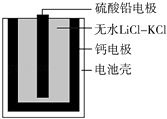
A.正極反應式:Ca+2Cl﹣﹣2e﹣═CaCl2
B.放電過程中,Li+向負極移動
C.每轉移0.1 mol電子,理論上生成20.7 g Pb
D.常溫時,在正負極間接上電流表或檢流計,指針不偏轉
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】等質量的氧氣和Y氣體,在相同溫度、相同容積的密閉容器中,氧氣的壓強大于Y氣體,則Y可能為( )
A. CH4B. NOC. C2H4D. CO2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學做了如下四組實驗:①號試管中豆漿+雙縮脲試劑:②號試管中氨基酸溶液+雙縮脲試劑:③號試管中淀粉+淀粉酶+雙縮脲試劑;④號試管中煮沸后的淀粉酶+雙縮脲試劑。四組實驗中出現紫色的有
A. 四組B. 三組C. 兩組D. 一組
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在2L密閉容器中,800℃時反應2NO(g)+O2(g)2NO2(g)體系中,n(NO)隨時間的變化如下表:
時間/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)寫出該反應的平衡常數表達式:K= , 已知:K(300℃)>K(350℃),該反應是反應(填“放熱”或“吸熱”).
(2)圖中表示NO2的變化的曲線是 , 用O2的濃度變化表示從0~2s內該反應的平均速率v=
(3)能說明該反應已經達到平衡狀態的是
a.v(NO2)=2v(O2) b.容器內壓強保持不變
c.v逆(NO)=2v正(O2) d.容器內物質的密度保持不變
(4)能使該反應的反應速率增大,且平衡向正反應方向移動的是
a.及時分離出NO2氣體 b.適當升高溫度
c.增大O2的濃度 d.選擇高效的催化劑.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度時,向2.0L恒容密閉容器中充入2mol SO2和1mol O2 , 發生反應:2SO2(g)+O2(g)2SO3(g).經過一段時間后達到平衡.反應過程中測定的部分數據見下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列說法正確的是( )
A.反應在前2 s 的平均速率v(O2)=0.4 molL﹣1s﹣1
B.保持其他條件不變,體積壓縮到1.0 L,平衡常數將增大
C.相同溫度下,起始時向容器中充入4 mol SO3 , 達到平衡時,SO3的轉化率大于10%
D.保持溫度不變,向該容器中再充入2 mol SO2、1 mol O2 , 反應達到新平衡時n(SO3)/n(O2)增大
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com