
【題目】乙酸乙酯是無(wú)色具有水果香味的液體,沸點(diǎn)為77.2 ℃,實(shí)驗(yàn)室某次制取乙酸乙酯用醋酸14.3 mL、95%乙醇23 mL,還用到濃硫酸、飽和碳酸鈉以及極易與乙醇結(jié)合的氯化鈣溶液。主要裝置如圖所示:
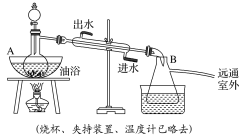
實(shí)驗(yàn)步驟:
①先向A中的蒸餾燒瓶中注入少量乙醇和濃硫酸后搖勻,再將剩下的所有乙醇和冰醋酸注入分液漏斗里待用。這時(shí)分液漏斗里醋酸和乙醇的物質(zhì)的量之比約為5∶7。
②加熱油浴保溫約135~145 ℃。
③將分液漏斗中的液體緩緩滴入蒸餾燒瓶里,調(diào)節(jié)加入速率使蒸出酯的速率與進(jìn)料速率大體相等,直到加料完成。
④保持油浴溫度一段時(shí)間,至不再有液體餾出后,停止加熱。
⑤取下B中的錐形瓶,將一定量飽和Na2CO3溶液分批少量多次地加到餾出液里,邊加邊振蕩,至無(wú)氣泡產(chǎn)生為止。
⑥將⑤的液體混合物分液,棄去水層。
⑦將飽和CaCl2溶液(適量)加入分液漏斗中,振蕩一段時(shí)間后靜置,放出水層(廢液)。
⑧分液漏斗里得到的是初步提純的乙酸乙酯粗品。
試回答:
(1)實(shí)驗(yàn)中濃硫酸的主要作用是_____。
(2)用飽和Na2CO3溶液洗滌粗酯的目的是______。如果用NaOH溶液代替Na2CO3溶液將引起的后果是____。
(3)用飽和CaCl2溶液洗滌粗酯的目的是_____。
(4)在步驟⑧所得的粗酯里還含有的雜質(zhì)是____。
【答案】催化劑和吸水劑 與揮發(fā)出來(lái)的乙酸反應(yīng)、溶解揮發(fā)出來(lái)的乙醇,降低乙酸乙酯的溶解度 使揮發(fā)出來(lái)的乙酸乙酯水解而使實(shí)驗(yàn)失敗 除去乙醇 水
【解析】
(1)酯化反應(yīng)中濃硫酸起到催化作用和吸水作用;
(2)飽和碳酸鈉溶液能與乙酸反應(yīng)除去乙酸、溶解乙醇、同時(shí)降低乙酸乙酯的溶解度,便于分層;乙酸乙酯在強(qiáng)堿性條件下發(fā)生水解反應(yīng);
(3)乙醇和氯化鈣會(huì)能形成絡(luò)合物,飽和CaCl2溶液可以吸收乙酸乙酯中可能殘留的乙醇;
(4)飽和CaCl2溶液可以吸收乙酸乙酯中可能殘留的乙醇,這樣分離出的粗酯中還含有水。
:
(1)乙酸與乙醇發(fā)生酯化反應(yīng),需濃硫酸作催化劑,又因?yàn)樵摲磻?yīng)為可逆反應(yīng),濃硫酸吸水后利于平衡向生成乙酸乙酯方向移動(dòng),故濃硫酸的作用為催化劑和吸水劑,故答案為:催化劑和吸水劑;
(2)制備乙酸乙酯時(shí)常用飽和碳酸鈉溶液,目的是中和揮發(fā)出來(lái)的乙酸,使之轉(zhuǎn)化為乙酸鈉溶于水中,同時(shí)溶解揮發(fā)出來(lái)的乙醇,這樣更便于聞乙酸乙酯的香味;降低乙酸乙酯在水中的溶解度,便于分層得到乙酸乙酯;由于乙酸乙酯在強(qiáng)堿性條件下發(fā)生水解反應(yīng)使最終得不到乙酸乙酯,使實(shí)驗(yàn)失敗;故答案為:與揮發(fā)出來(lái)的乙酸反應(yīng)、溶解揮發(fā)出來(lái)的乙醇,降低乙酸乙酯的溶解度;使揮發(fā)出來(lái)的乙酸乙酯水解而使實(shí)驗(yàn)失敗;
(4)由于乙醇和氯化鈣會(huì)能形成絡(luò)合物,故可以用飽CaCl2溶液來(lái)吸收乙酸乙酯中可能殘留的乙醇,故答案為:除去乙醇;
(5)飽和碳酸鈉溶液除掉了乙酸和乙醇,飽和CaCl2溶液可以進(jìn)一步吸收乙酸乙酯中可能殘留的乙醇,這樣分離出的粗酯中還含有雜質(zhì)水,故答案為:水。



| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來(lái)源: 題型:
【題目】某同學(xué)設(shè)計(jì)了蔗糖與濃硫酸反應(yīng)的改進(jìn)裝置,并對(duì)氣體產(chǎn)物進(jìn)行檢驗(yàn),實(shí)驗(yàn)裝置如圖所示。下列結(jié)論中正確的是( )
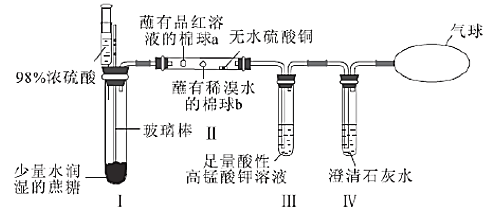
選項(xiàng) | 現(xiàn)象 | 結(jié)論 |
A. | Ⅰ中注入濃硫酸后,可觀(guān)察到試管中白色固體變?yōu)楹谏?/span> | 體現(xiàn)了濃硫酸的吸水性 |
B. | Ⅱ中觀(guān)察到棉球a、b都褪色 | 均體現(xiàn)了SO2的漂白性 |
C. | Ⅱ中無(wú)水硫酸銅變藍(lán) | 說(shuō)明反應(yīng)產(chǎn)物中有H2O |
D. | Ⅲ中溶液顏色變淺,Ⅳ中澄清石灰水變渾濁 | 說(shuō)明有CO2產(chǎn)生 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】如圖是模擬“侯氏制堿法”制取NaHCO3的部分裝置。下列操作正確的是( )

A. a通入CO2,然后b通入NH3,c中放堿石灰
B. b通入NH3,然后a通入CO2,c中放堿石灰
C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脫脂棉
D. b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脫脂棉
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】釩鋰鋰離子電池具有較大的比容量、低廉的價(jià)格等優(yōu)點(diǎn)。一種釩鋰鋰離子二次電池的結(jié)構(gòu)示意圖如圖,其負(fù)極反應(yīng)為:CmLin-xe-=CmLin-x+xLi+(CmLin表示鋰原子嵌入石墨形成的復(fù)合材料),放電時(shí)的總反應(yīng)為:CmLin+LiV3O8=CmLin-x+Li1+xV3O8。
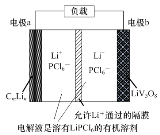
下列說(shuō)法正確的是( )
A.放電時(shí)Li+由正極區(qū)移向負(fù)極區(qū)
B.充電時(shí)電極a與外接電源的正極相連
C.充電時(shí)陽(yáng)極為Li1+xV3O8-xe-=LiV3O8+xLi+
D.正極質(zhì)量每增加2.1g,電路中轉(zhuǎn)移的電子數(shù)為0.1mol
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】已知:①A的產(chǎn)量通常用來(lái)衡量一個(gè)國(guó)家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。現(xiàn)以A為主要原料合成化合物E,其合成路線(xiàn)如圖1所示。回答下列問(wèn)題:
2CH3COOH。現(xiàn)以A為主要原料合成化合物E,其合成路線(xiàn)如圖1所示。回答下列問(wèn)題:

(1)寫(xiě)出下列物質(zhì)的官能團(tuán)名稱(chēng):B:____________________;D:____________________。
(2)反應(yīng)④的化學(xué)方程式為________________________________________________,反應(yīng)類(lèi)型:________。
(3)某學(xué)習(xí)小組設(shè)計(jì)物質(zhì)B催化氧化的實(shí)驗(yàn)裝置如下,根據(jù)圖2裝置回答問(wèn)題。

①裝置甲錐形瓶中盛放的固體藥品可能為________(填字母)。
A.Na2O2 B.KClC.Na2CO3 D.MnO2
②實(shí)驗(yàn)過(guò)程中,丙裝置硬質(zhì)玻璃管中發(fā)生反應(yīng)的化學(xué)方程式為_______________________________。
③物質(zhì)B的催化氧化產(chǎn)物與葡萄糖具有相同的特征反應(yīng),將所得的氧化產(chǎn)物滴加到新制氫氧化銅懸濁液中加熱,現(xiàn)象為______________________________________________。
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】一定溫度下,在三個(gè)容積相同的恒容密閉容器中按不同方式投入物質(zhì),發(fā)生反應(yīng):PCl3(g)+Cl2(g)![]() PCl5(g) ΔH<0,測(cè)得反應(yīng)的相關(guān)數(shù)據(jù)如下:
PCl5(g) ΔH<0,測(cè)得反應(yīng)的相關(guān)數(shù)據(jù)如下:
容器1 | 容器2 | 容器3 | |
溫度/℃ | 200 | 300 | 200 |
起始物質(zhì)投入量 | 1molPCl3、2molCl2 | 2molPCl3、1molCl2 | 2molCl2、2molPCl5 |
平衡c(PCl5)/mol·L-1 | c1 | c2 | c3 |
化學(xué)平衡常數(shù) | K1 | K2 | K3 |
平衡體系總壓強(qiáng)p/Pa | p1 | p2 | p3 |
物質(zhì)的轉(zhuǎn)化率α | α1(PCl3) | α2(Cl2) | α3(PCl5) |
下列說(shuō)法正確的是( )
A.K1<K2
B.c1<c2
C.p3=2p1
D.α1(PCl3)+α3(PCl5)<1
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
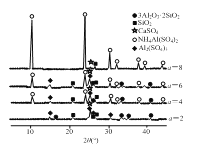
【題目】以粉煤灰(主要含3Al2O3·2SiO2、SiO2,還含有少量CaO、Fe2O3等物質(zhì))為原料制取Al2O3的流程如圖:
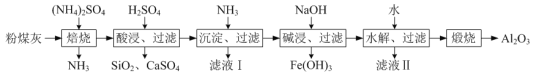
(1)當(dāng)(NH4)2SO4和3Al2O3·2SiO2的配比a(a=![]() )不同時(shí),“焙燒”后所得產(chǎn)物的X射線(xiàn)衍射譜圖如圖所示(X射線(xiàn)衍射可用于判斷某晶態(tài)物質(zhì)是否存在,不同晶態(tài)物質(zhì)出現(xiàn)衍射峰的衍射角不同)。由圖可知,當(dāng)a=___時(shí),3Al2O3·2SiO2的利用率最高。
)不同時(shí),“焙燒”后所得產(chǎn)物的X射線(xiàn)衍射譜圖如圖所示(X射線(xiàn)衍射可用于判斷某晶態(tài)物質(zhì)是否存在,不同晶態(tài)物質(zhì)出現(xiàn)衍射峰的衍射角不同)。由圖可知,當(dāng)a=___時(shí),3Al2O3·2SiO2的利用率最高。
(2)“沉淀、過(guò)濾”所得濾渣為Fe(OH)3和Al(OH)3,生成Fe(OH)3的離子反應(yīng)方程式為___。
(3)“堿浸”加入NaOH發(fā)生反應(yīng)的離子方程式為___。
(4)“水解、過(guò)濾”可得到Al(OH)3沉淀,升高溫度有利于水解的原因是___。該步驟可將加水改成通入過(guò)量的___氣體。
(5)流程中,可以回收并循壞利用的物質(zhì)除NH3外,還有___和___。
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】某化學(xué)課外活動(dòng)小組通過(guò)實(shí)驗(yàn)探究NO2的性質(zhì)。已知:2NO2+2NaOH=NaNO3+NaNO2+H2O。任務(wù)1:利用如圖所示裝置探究NO2能否被NH3還原(夾持固定裝置已略去)。
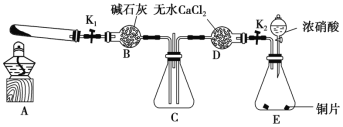
請(qǐng)回答下列問(wèn)題:
(1)E裝置中制取NO2的化學(xué)方程式是_____________________________。
(2)此實(shí)驗(yàn)裝置存在的一個(gè)明顯缺陷是_______________________________________。
任務(wù)2:探究NO2能否與Na2O2發(fā)生氧化還原反應(yīng)。
(3)實(shí)驗(yàn)前,該小組同學(xué)提出三種假設(shè)。
假設(shè)1:二者不反應(yīng);假設(shè)2:NO2能被Na2O2氧化;
假設(shè)3:________________________________________________。
(4)為了驗(yàn)證假設(shè)2,該小組同學(xué)選用任務(wù)1中的B、D、E裝置,將B中的藥品更換為Na2O2,另選F裝置(如圖所示),重新組裝,進(jìn)行實(shí)驗(yàn)。

①裝置的合理連接順序是(某些裝置可以重復(fù)使用)_________________。
②實(shí)驗(yàn)過(guò)程中,B裝置中淡黃色粉末逐漸變成白色。經(jīng)檢驗(yàn),該白色物質(zhì)為純凈物,且無(wú)其他物質(zhì)生成。推測(cè)B裝置中發(fā)生反應(yīng)的化學(xué)方程式為______________________。
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】如圖曲線(xiàn)表示其他條件一定時(shí),反應(yīng)2NO+O2![]() 2NO2(正反應(yīng)為放熱反應(yīng))達(dá)平衡時(shí)NO的轉(zhuǎn)化率與溫度的關(guān)系曲線(xiàn),圖中標(biāo)有a、b、c、d四點(diǎn),其中表示未達(dá)到平衡狀態(tài),且v(正)>v(逆)的點(diǎn)是()
2NO2(正反應(yīng)為放熱反應(yīng))達(dá)平衡時(shí)NO的轉(zhuǎn)化率與溫度的關(guān)系曲線(xiàn),圖中標(biāo)有a、b、c、d四點(diǎn),其中表示未達(dá)到平衡狀態(tài),且v(正)>v(逆)的點(diǎn)是()
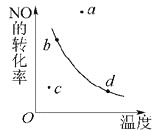
A.a點(diǎn)B.b點(diǎn)C.c點(diǎn)D.d點(diǎn)
查看答案和解析>>
國(guó)際學(xué)校優(yōu)選 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專(zhuān)區(qū) | 電信詐騙舉報(bào)專(zhuān)區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專(zhuān)區(qū) | 涉企侵權(quán)舉報(bào)專(zhuān)區(qū)
違法和不良信息舉報(bào)電話(huà):027-86699610 舉報(bào)郵箱:58377363@163.com