
【題目】下列氣態氫化物中,最穩定的是
A.NH3B.H2OC.HClD.HF
科目:高中化學 來源: 題型:
【題目】500mLKNO3和Cu(NO3)2的混合溶液中,c(NO3)=6.0mol/L.用石墨作電極電解此溶液,當通電一段時間后,兩極都收集到22.4L氣體(標準狀況),假設電解后溶液的體積仍為500mL.下列說法正確的是( )
A.原混合溶液中K+的物質的量濃度為1 mol/L
B.上述電解過程中共轉移4mol電子
C.電解得到的Cu的物質的量為0.5mol
D.電解后溶液中H+的物質的量濃度為2mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究NO2、NO、SO2 、CO等大氣污染氣體的處理具有重要意義。
(1)已知: CO可將部分氮的氧化物還原為N2。
反應I :2CO(g)+2NO(g) ![]() N2(g)+2CO2(g) △H=-746kJ.mol-1
N2(g)+2CO2(g) △H=-746kJ.mol-1
反應II :4CO(g)+2NO2(g) ![]() N2(g)+4CO2(g) △H=-1200kJ.mol-1
N2(g)+4CO2(g) △H=-1200kJ.mol-1
則反應NO2(g)+CO(g) ![]() CO2(g)+NO(g)的△H=______kJ/mol。
CO2(g)+NO(g)的△H=______kJ/mol。
(2)一定條件下,將NO2與CO以體積比1:2置于密閉容器中發生反應II,下列能說明反應達到平衡狀態的是________。
a.體系壓強保持不變 b.容器中氣體密度保持不變
c.混合氣體顏色保持不變 d.每消耗2molNO2的同時生成1molN2
(3)溫度為T、容積為10L的恒容密閉容器中,充入1molCO和0.5 mol SO2發生反應:2CO(g)+SO2(g)![]() 2CO2(g)+S(g) 實驗測得生成的CO2體積分數(φ) 隨著時間的變化曲線如圖所示:
2CO2(g)+S(g) 實驗測得生成的CO2體積分數(φ) 隨著時間的變化曲線如圖所示:

①達到平衡狀態時,SO2的轉化率為__,該溫度下反應的平衡常數K=______。
②其它條件保持不變,再向上述平衡體系中充入SO2(g).CO(g)、S(g)、CO2(g)各0.2mol,此時v(正)___v(逆) (填“>”“<”或“=”)。
(4)SCR法是工業上消除氦氧化物的常用方法,反應原理為4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) △H<0.在催化劑作用下,NO轉化率與溫度的關系如圖所示:
4N2(g)+6H2O(g) △H<0.在催化劑作用下,NO轉化率與溫度的關系如圖所示:

圖中A點處NO的轉化率_______(填“可能是”、“一定是 ”或“一定不是”)該溫度下的平衡轉化率;B點之后,NO轉化率降低的原因可能是________。
A.平衡常數變大 B.副反應增多
C.催化劑活性降低 D.反應活化能增大
(5)2SO2(g)+O2(g) ![]() 2SO3(g) △H=-198kJ.mol-l 是制備硫酸的重要反應。在VL恒容密閉容器中充入2molSO2和1molO2,在不同條件下進行反應,反應體系總壓強隨時間的變化如圖所示。a和b平衡時,SO3體積分數較大的是_______; 判斷的依據是________。
2SO3(g) △H=-198kJ.mol-l 是制備硫酸的重要反應。在VL恒容密閉容器中充入2molSO2和1molO2,在不同條件下進行反應,反應體系總壓強隨時間的變化如圖所示。a和b平衡時,SO3體積分數較大的是_______; 判斷的依據是________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖為EFC劍橋法用固體二氧化鈦(TiO2)生產海綿鈦的裝置示意圖,其原理是在較低的陰極電位下,TiO2(陰極)中的氧解離進入熔鹽,陰極最后只剩下純鈦。下列說法中正確的是( )

A. 陽極的電極反應式為2Cl--2e-===Cl2↑ B. 陰極的電極反應式為TiO2+4e-===Ti+2O2-
C. 通電后,O2-、Cl-均向陰極移動 D. 石墨電極的質量不發生變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,p、q為直流電源的兩極,A由金屬單質X制成,B、C、D為鉑電極,接通電源,金屬X沉積于B極,同時C、D上產生氣泡,試回答: 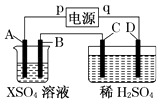
(1)p為極,A極發生了反應.
(2)C為極,可收集到;D為極,可收集到 .
(3)C極的電極反應式為 .
(4)在電解過程中,測C、D兩極上產生氣體的體積,實驗數據如表:
時間(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
陰極產生氣體的體積(cm3) | 6 | 12 | 20 | 29 | 39] | 49 | 59 | 69 | 79 | 89 |
陽極產生氣體的體積(cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
仔細分析以上實驗數據,請說出變化的可能原因是 .
(5)當反應進行一段時間后,A、B電極附近溶液的pH(填“增大”“減小”或“不變”).
(6)當電路中通過0.004mol電子時,B極上沉積的金屬X為0.128g,則此金屬的摩爾質量為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】輝銅礦石主要含有硫化亞銅(Cu2S)及少量脈石(SiO2)。一種以輝銅礦石為原料制備硝酸銅的工藝流程如下所示:(已知:硫不溶于水,微溶于酒精,易溶于二硫化碳、四氯化碳和苯。)

(1)寫出“浸取”過程中Cu2S溶解時發生反應的離子方程式:____________。
(2)“回收S”過程中溫度控制在50~60 ℃之間,不宜過高或過低的原因是_____________________。
(3)氣體NOx與氧氣混合后通入水中能生成流程中可循環利用的一種物質,該反應的化學方程式為_________________。向“濾液M”中加入(或通入)____(填字母),可得到另一種可循環利用的物質。 a.鐵 b.氯氣 c.高錳酸鉀
(4)“保溫除鐵”過程中,加入CuO的目的是__________________;“蒸發濃縮、冷卻結晶”過程中,加入HNO3調節溶液的pH,其理由是___________。
(5)洗滌硝酸銅晶體的洗滌劑可以使用下列物質中的______________。
a.酒精 b.熱水 c.飽和硝酸銅溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中國科學家用蘸墨汁書寫后的紙張作為空氣電極,設計并組裝了輕型、柔性、能折疊的可充電鋰空氣電池如下圖1,電池的工作原理如下圖2。下列有關說法正確的是

A. 放電時,紙張中的纖維素作鋰電池的正極
B. 開關K閉合給鋰電池充電,X為直流電源負極
C. 放電時,Li+由正極經過有機電解質溶液移向負極
D. 充電時,陽極的電極反應式為:Li2O2+2e-=O2↑+2Li+
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com