
室溫下,向下列溶液中通入相應的氣體至溶液pH=7(通入氣體對溶液體積的影響可忽略),溶液中部分微粒的物質的量濃度關系正確的是( )
A.向0.10mol·L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-)
B.0.10mol·L-1CH3COONa溶液中通入HCl:c(Na+)>c(Cl-)>c(CH3COOH)
C.0.10mol·L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
D.向0.10mol·L-1NaHSO3溶液中通入NH3:c(Na+)>c(SO32-)>c(NH4+)
科目:高中化學 來源:2015-2016學年山西省高一下期中化學試卷(解析版) 題型:選擇題
下列反應既能屬于氧化還原反應,又屬于吸熱反應的是
A.鋁片與稀鹽酸的反應
B.Ba(OH)2·8H2O與NH4Cl的反應
C.灼熱的炭與CO2的反應
D.硫在氧氣中的燃燒反應
查看答案和解析>>
科目:高中化學 來源:2016屆浙江省寧波市等十校高三3月聯考理綜化學試卷(解析版) 題型:選擇題
常溫下 0.1mol/L的H2A溶液中H2A、HA-、A2- 三者中所占物質的量分數(分布系數)隨pH變化的關系如圖所示。下列表述不正確的是( )
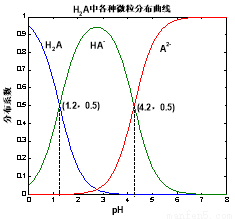
A.H2A 2H+ + A2- K=10-5.4
2H+ + A2- K=10-5.4
B.在 0.1mol/L NaHA 溶液中,各離子濃度大小關系為:
c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C.已知25℃時HF的 Ka=10-3.45,將少量H2A的溶液加入足量NaF溶液中,發生的反應為: H2A+F-═ HF+HA-
D.將等物質的量的NaHA、Na2A溶于水中,所得溶液pH恰好為4.2
查看答案和解析>>
科目:高中化學 來源:2016屆陜西省高三第六次適應性考試理綜化學試卷(解析版) 題型:選擇題
設NA為阿伏加德羅常數的值。下列說法正確的是
A.一定條件下,將1 mol N2和3 mol H2混合發生反應,轉移的電子總數為6 NA
B.1 L 0.1 mol·L-1的Na2CO3溶液中陰離子的總數大于0.1 NA
C.向FeI2溶液中通入適量Cl2,當有2 mol Fe2+被氧化時,消耗Cl2的分子數為NA
D.1 mol-CH3中所含的電子總數為10 NA
查看答案和解析>>
科目:高中化學 來源:2016屆吉林省高三第八次模擬理綜化學試卷(解析版) 題型:填空題
氫能是重要的新能源。儲氫作為氫能利用的關鍵技術,是當前關注的熱點之一。
(1)氫氣是清潔能源,其燃燒產物為__________。
(2)NaBH4是一種重要的儲氫載體,能與水反應生成NaBO2,且反應前后B的化合價不變,該反應的化學方程式為 _,反應消耗1mol NaBH4時轉移的電子數目為__________。
(3)儲氫還可借助有機物,如利用環己烷和苯之間的可逆反應來實現脫氫和加氫:
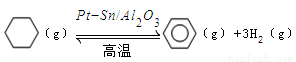 。
。
某溫度下,向恒容密閉容器中加入環己烷,起始濃度為a mol/L,平衡時苯的濃度為bmol/L,該反應的平衡常數K= 。
(4)一定條件下,圖示裝置可實現有機物的電化學儲氫(忽略其它有機物)。
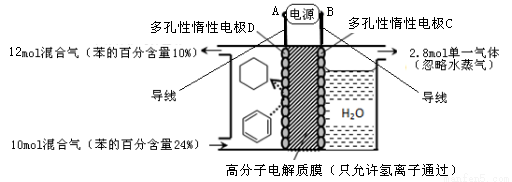
①導線中電子移動方向為 → 。(用A、B、C、D填空)
②生成目標產物的電極反應式為 。
③該儲氫裝置的電流效率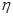 = 。(
= 。(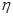 =
= ,計算結果保留小數點后1位)
,計算結果保留小數點后1位)
查看答案和解析>>
科目:高中化學 來源:2016屆吉林省高三第二次模擬理綜化學試卷(解析版) 題型:實驗題
【化學——選修2:化學與技術】
硝酸銨可用作化肥、軍用炸藥、殺蟲劑、冷凍劑等,工業制取硝酸銨的工藝流程如下:
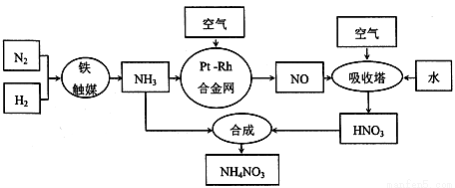
(l)合成氨氣的工業設備名稱是__________,設備中設置熱交換器的目的是_______________,合成氨的原料氣必須先脫硫,目的是_________________________________;
(2)吸收塔中反應的化學方程式為___________________,從生產流程看,吸收塔中需要補充空氣,其原因是__________________________;
(3)生產硝酸的過程中常會產生氮的氧化物,可用如下三種方法處理:
方法一:堿性溶液吸收法
NO+NO2+2NaOH=2NaNO2+H2O;2NO2+Na2CO3=NaNO2+NaNO3+CO2
方法二:NH3還原法
8NH3(g)+6NO2(g)=7N2(g)+12H2O(g) △H =-2635 kJ/mol(NO也有類似的反應)
方法三:甲烷吸收法
CH4(g)+2NO2=CO2(g)+N2+2H2O(g) △H=+867 kJ/mol(NO也有類似的反應)
上述三種方法中,方法一的主要缺點是_______________________________;
方法三和方法二相比,方法三的缺點是_________________________;
(4)工業上也可以通過電解NO制備NH4NO3,其工作原理如下圖所示。
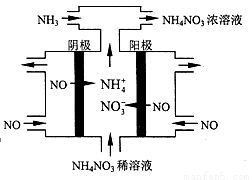
①圖中通入NH3的目的是_____________;
②若維持電流強度為3A,電解2小時,理論上可制得NH4NO3的最大質量為_________g;
(已知F=96500 C·mol-l)(保留2位有效數字)。
(5)某化肥廠用NH3制備NH4NO3。己知:NH3制NO的產率是94%,NO制HNO3的產率是89%,則制HNO3所用NH3的質量占總耗NH3質量(不考慮其他損耗)的百分比為______。
查看答案和解析>>
科目:高中化學 來源:2016屆吉林省高三第二次模擬理綜化學試卷(解析版) 題型:選擇題
短周期元素X、Y、Z、W在元素周期表中的相對位置如圖所示,其中Z所處的族序數是周期序數的2倍。下列判斷不正確的是
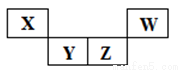
A.最高正化合價:X<Y<Z
B.原子半徑:X<Y<Z
C.氣態氫化物的熱穩定性:Z<W
D.最高價氧化物對應水化物的酸性:X<Z
查看答案和解析>>
科目:高中化學 來源:2015-2016學年寧夏六盤山高中高一下期中化學試卷(解析版) 題型:填空題
某汽車安全氣囊的產氣藥劑主要含有NaN3、Fe2O3、KClO4、NaHCO3等物質。當汽車發生碰撞時,產氣藥劑產生大量氣體使氣囊迅速膨脹,從而起到保護作用。
(1)NaN3是氣體發生劑,受熱分解產生N2和Na,N2的電子式為
(2)Fe2O3是主氧化劑,與Na反應生成的還原產物為 (已知該反應為置換反應).
(3)KClO4是助氧化劑,反應過程中與Na作用生成KCl和Na2O,KClO4含有化學鍵的類型為 ,KCl在灼燒時得焰色為 色。
(4)NaHCO3是冷卻劑,吸收產氣過程中釋放的熱量而發生分解,其化學方程式為 。
(5)100g上述產氣藥劑產生的氣體通過堿石灰后得到N2 33.6L(標準狀況)。
①用堿石灰除去的物質為 ;
②該產氣藥劑中NaN3的質量分數為 。(4分)
查看答案和解析>>
科目:高中化學 來源:2016屆海南海南中學高三考前模擬十一化學試卷(解析版) 題型:選擇題
短周期元素X、Y、Z的原子序數依次遞增,X與Y、Z位于相鄰周期,X形成的常見含氧酸能氧化氫后金屬,Y、Z原子最外層電子數之比為3:7,下列說法正確的是
A.X的常見氫化物水溶液顯弱堿性
B.組成為HZO的物質結構式為H—Z—O
C.最高價氧化物對應水化物酸性:Z>X>Y
D.簡單離子半徑:Z>Y>X
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com