
【題目】現有三組混合物:①CCl4和NaCl的混合液;②苯(沸點:80.1℃)和甲苯(沸點:110.6℃)的混合溶液(苯和甲苯是性質非常相似的一對互溶液體);③摻有碘化鉀的碘水,分離以上各混合液的正確方法依次是
A. 分液、蒸餾、萃取 B. 萃取、蒸餾、分液
C. 蒸餾、萃取、分液 D. 分液、萃取、蒸餾
 通城學典默寫能手系列答案
通城學典默寫能手系列答案 金牌教輔培優優選卷期末沖刺100分系列答案
金牌教輔培優優選卷期末沖刺100分系列答案科目:高中化學 來源: 題型:
【題目】已知水的電離平衡曲線如圖所示,試回答下列問題:

(1)圖中五點kw間的關系是_____________。
(2)若從A點到D點,可采用的措施是 。
a.升溫 b.加入少量的鹽酸 c.加入少量的NH4Cl
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】加壓降溫可以使空氣液化,在此過程中,下列說法正確的是
A.空氣中的分子質量變大 B.空氣中的分子間隔變小
C.空氣中的分子種類改變 D.空氣中的分子數目變少
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】0.5L 1mol/L FeCl3溶液與0.2L 1mol/L KCl溶液中的Cl﹣的物質的量濃度之比( )
A.5:2
B.3:1
C.15:2
D.1:3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在相同的溫度和壓強下,4個相同體積的密閉容器中分 別裝有4種氣體.則4個容器中氣體的質量最大是( )
A.CO2 ,
B.O2
C.N2
D.CH4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳及其化合物有廣泛的用途。
(1)C(s)+H2O(g)![]() CO(g) +H2(g) ΔH= +131.3 kJ·mol-1,以上反應達到平衡后,在體積不變的條件下,以下措施有利于提高H2的產率的是 。(填序號)
CO(g) +H2(g) ΔH= +131.3 kJ·mol-1,以上反應達到平衡后,在體積不變的條件下,以下措施有利于提高H2的產率的是 。(填序號)
A.升高溫度 B.增加碳的用量
C.加入催化劑 D.用CO吸收劑除去CO
(2)又知,C(s)+ CO2(g)![]() 2CO(g) △H=+172.5kJ·mol-1
2CO(g) △H=+172.5kJ·mol-1
則CO(g)+H2O(g)![]() CO2(g)+H2(g)的△H= 。
CO2(g)+H2(g)的△H= 。
(3)CO與H2在一定條件下可反應生成甲醇,甲醇是一種燃料,可利用甲醇設計一個燃料電池,用稀硫酸作電解質溶液,多孔石墨做電極,該電池負極反應式為 。
(4)在一定溫度下,將CO(g)和H2O(g)各0.16 mol分別通入到體積為2.0L的恒容密閉容器中,發生以下反應:CO(g)+H2O(g) ![]() CO2(g)+H2(g),得到如下數據:
CO2(g)+H2(g),得到如下數據:
t / min | 2 | 4 | 7 | 9 |
n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
①其他條件不變,降低溫度,反應達到新平衡前v(逆)________v(正)(填“>”、“<”、“=”)
②該溫度下此反應的平衡常數K=___________
③其他條件不變,再充入0.1mol CO和0.1mol H2O(g),平衡時CO的體積分數___________(填“增大”、“減小”、“不變”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列能用勒沙特列原理解釋的是( )
A.Fe(SCN)3溶液中加入固體KSCN后顏色變深
B.棕紅色NO2加壓后顏色先變深后變淺
C.SO2催化氧化成SO3的反應,往往需要使用催化劑
D.H2、I2、HI平衡混和氣加壓后顏色變深
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.在恒溫條件下,將一定量X和Y的混合氣體通入一容積為2 L的密閉容器中,X和Y兩物質的濃度隨時間變化情況如下圖。
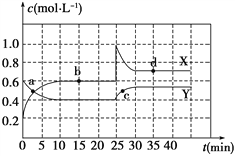
(1)該反應的化學方程式為(反應物或生成物用符號X、Y表示):____________________。
(2)0~10min化學反應速度V(X)=__________________。
(3)比較Y在0~10min和10~20min時平均反應速率的大小:v(0~10)_______ v(10~20)(填“<”、“>”或“=”),原因是________________。
(4) a、b、c、d四個點中,表示化學反應處于平衡狀態的點是_________,理由是__________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com