
【題目】已知25℃時,電離常數Ka(HF)=3.6×104 mol/L,溶度積常數Ksp(CaF2)=1.46×1010 mol3·L3。現向1 L0.2 mol/L HF溶液中加入1 L 0.2 mol/L CaCl2溶液,則下列說法中,正確的是
A. 25℃時,0.1 mol/L HF溶液中pH=1
B. Ksp(CaF2)隨溫度和濃度的變化而變化
C. 該體系中Ksp(CaF2)=![]()
D. 該體系中有CaF2沉淀產生
科目:高中化學 來源: 題型:
【題目】實驗室可用KMnO4和濃鹽酸反應制取氯氣。
KMnO4+HCl(濃)=KCl+MnCl2+Cl2↑+H2O(未配平)
(1)配平化學方程式,并用單線橋標出電子轉移的方向和數目。
(2)將上述配平的化學方程式改寫為離子方程式 。
(3)濃鹽酸在反應中顯示出來的性質是________________
①只有還原性 ②還原性和酸性
③只有氧化性 ④氧化性和酸性
(4)若產生0.5molCl2,則被氧化的HCl mol,轉移的電子的數目約為___________。
(5)一定條件下,KMnO4還可以氧化其他還原性物質。
MnO4-+C2O42-+ = Mn2+ +CO2↑+
完成上述離子方程式,此反應中,發生氧化反應的物質是 ;若轉移1mol電子,生成標準狀況下CO2 L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于反應CO(g)+H2O(g)![]() CO 2(g)+ H 2(g) △H﹤0,在其他條件不變的情況下
CO 2(g)+ H 2(g) △H﹤0,在其他條件不變的情況下
A. 加入催化劑,改變了反應的途徑,反應的△H也隨之改變
B. 改變壓強,平衡不發生移動,反應放出的熱量不變
C. 升高溫度,反應速率加快,反應放出的熱量不變
D. 若在原電池中進行,反應放出的熱量不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在4 L密閉容器中充入6 mol A氣體和5 mol B氣體,在一定條件下發生反應:3A(g)+B(g)![]() 2C(g)+xD(g),達到平衡時,生成了2 mol C,經測定,D的濃度為0.5 mol·L-1,下列判斷正確的是( )。
2C(g)+xD(g),達到平衡時,生成了2 mol C,經測定,D的濃度為0.5 mol·L-1,下列判斷正確的是( )。
A. x=1
B. B的轉化率為20%
C. 平衡時A的濃度為1.50 mol·L-1
D. 達到平衡時,在相同溫度下容器內混合氣體的壓強是反應前的85%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應Fe(s) +CO2 (g)![]() FeO(s)+CO(g),700℃時平衡常數為1.47,900℃時平衡常數為2.15。下列說法正確的是
FeO(s)+CO(g),700℃時平衡常數為1.47,900℃時平衡常數為2.15。下列說法正確的是
A. 升高溫度該反應的正反應速率增大,逆反應速率減小
B. 該反應的化學平衡常數表達式為K=![]()
C. 絕熱容器中進行該反應,溫度不再變化,則達到化學平衡狀態
D. 該反應的正反應是放熱反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】寫出下列物質發生水解反應的離子方程式
(1)Na2CO3溶液中滴加酚酞呈紅色,原因是__________(用離子方程式表示),加熱后顏色變 ___________________________。
(2)CH3COONa溶液PH___7(填“>”“<”或“=”),原因是__________(用離子方程式表示)。
(3)普通泡沫滅火器內的玻璃筒里﹣盛硫酸鋁溶液,鐵筒里﹣盛碳酸氫鈉溶液,其化學反應的原理是______(用離子方程式表示),不能把硫酸鋁溶液盛在鐵筒里的原因是(用離子方程式表示)______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】黃銅礦是工業冶煉銅的原料,主要成分為 CuFeS2。試回答下列問題:
(1)基態硫原子核外電子有_____種不同運動狀態,能量最高的電子所占據的原子軌道形狀為_________。
(2)基態Cu原子的價層電子排布式為_________;Cu、Zn的第二電離能大小I2(Cu) _________I2(Zn)(填“>”“<”或“=”)。
(3)SO2分子中S原子的軌道雜化類型為_________,分子空間構型為_________;與SO2互為等電子體的分子有_________(寫一種)。
(4)請從結構角度解釋H2SO3的酸性比H2SO4酸性弱的原因_________。
(5)Cu(CH3CN)4比四氨合銅離子穩定,其配離子中心原子配位數為_________,配位體中σ鍵與π鍵個數之比為_________。
(6)鐵鎂合金是目前已發現的儲氫密度最高的儲氫材料之一,其晶胞結構如圖所示。

若該晶體儲氫時,H2分子在晶胞的體心和棱的中心位置,距離最近的兩個H2分子之間距離為anm。則該晶體的密度為_________g/cm3(列出計算表達式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知下列反應的熱化學方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
2 H2(g)+ O2(g)= 2H2O(g)△H2
C(s)+ O2(g)=CO2(g)△H3
則反應4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H為
A. 12△H3+5△H2-2△H1 B. 2△H1-5△H2-12△H3
C. 12△H3-5△H2-2△H1 D. △H1-5△H2-12△H3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)已知拆開1 mol H—H鍵、1 mol N—H鍵、1 mol N≡N鍵需要的能量分別是436 kJ、391 kJ、946 kJ,則N2與H2反應生成NH3的熱化學方程式為_________________。
(2)已知化學反應A2(g)+B2(g)===2AB(g)的能量變化如圖所示,回答下列問題:
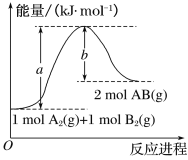
①該反應的ΔH_______0(填 “大于”“小于”或“等于”);
②反應物的總鍵能為______________;
③寫出該反應的熱化學方程式________________________________。
(3)聯氨(又稱肼,N2H4,無色液體)是一種應用廣泛的化工原料,可用作火箭燃料,回答下列問題:
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) ΔH 4=-1048.9kJ/mol
寫出聯氨的結構式_______________,上述反應熱效應之間的關系式為ΔH4=__________,聯氨和N2O4可作為火箭推進劑的主要原因為_______________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com