
【題目】十九大報告提出了“積極參與全球環境治理,落實減排承諾”。其中氮的化合物的處理和利用是環境科學研究的熱點。
(1)氮氧化物與懸浮大氣中的海鹽粒子相互作用會生成NOCl,涉及的相關反應有:
熱化學方程式 | 平衡常數 | |
|
|
|
|
|
|
|
|
|
![]() 、
、![]() 、
、![]() 之間的關系為
之間的關系為![]() ______;
______;![]() 、
、![]() 、
、![]() 的關系為
的關系為![]() ______。
______。
(2)對汽車加裝尾氣凈化裝置,可使汽車尾氣中含有的CO、![]() 等有毒氣體轉化為無毒氣體:
等有毒氣體轉化為無毒氣體:![]() 對于該反應,溫度不同
對于該反應,溫度不同![]() ,其他條件相同時,下列圖象正確的是______
,其他條件相同時,下列圖象正確的是______![]() 填序號
填序號![]() 。
。

(3)用活性炭還原法也可以處理氮氧化物。向某密閉容器中加入一定量的活性炭和NO,發生反應:![]() 在
在![]() 時,反應進行到不同時間測得各物質的濃度如下:
時,反應進行到不同時間測得各物質的濃度如下:
時間 濃度 | 0 | 10 | 20 | 30 | 40 | 50 |
NO |
|
|
|
|
|
|
| 0 |
|
|
|
|
|
| 0 |
|
|
|
|
|
![]() 時,該反應在
時,該反應在![]() 的平均反應速率
的平均反應速率![]() ______;該反應的平衡常數
______;該反應的平衡常數![]() ______;
______;
![]() 后只改變某一條件,根據上表數據判斷改變的條件可能是______
后只改變某一條件,根據上表數據判斷改變的條件可能是______![]() 填序號
填序號![]() ;
;
A.加入一定量的活性炭 ![]() 恒溫恒壓充入氬氣
恒溫恒壓充入氬氣
C.適當縮小容器的體積 ![]() 加入合適的催化劑
加入合適的催化劑
【答案】2ΔH1-ΔH2 ![]() 乙
乙 ![]()
![]() (9/16) C
(9/16) C
【解析】
(1)本題考查蓋斯定律和化學平衡常數的表達式,根據③的反應,因此有①×2-②得出△H3;①K1=![]() ,②K2=
,②K2=![]() ,③K3=
,③K3=![]() ,因此有K3=
,因此有K3=![]() ;
;
(2)本題考查影響化學反應速率的因素和勒夏特列原理,甲:升高溫度,化學反應速率加快,即升高溫度,正逆反應速率都增大;乙:T2>T1,T2先達到平衡,正反應是放熱反應,升高溫度,平衡向逆反應方向移動,則NO2的轉化率降低;丙:升高溫度,平衡向逆反應方向移動,CO的體積分數增大;
(3)本題考查化學反應速率的計算、化學平衡常數的計算、勒夏特列原理,①根據化學反應速率的數學表達式求算,根據化學平衡常數的表達式K=![]() 求算;
求算;
②A、加入活性炭,活性炭為固體,對化學平衡移動無影響;
B、恒溫恒壓下,充入氬氣,容器的體積增大,組分的濃度降低;
C、適當縮小容器的體積,組分的濃度增大;
D、加入合適的催化劑,催化劑對化學平衡移動無影響。
(1)根據蓋斯定律和化學平衡常數的表達式可知,根據③的反應,因此有①×2-②得出△H3=2△H1-△H2,①K1=![]() ,②K2=
,②K2=![]() ,③K3=
,③K3=![]() ,因此有K3=
,因此有K3=![]() ;
;
(2)甲:升高溫度,化學反應速率加快,即升高溫度,正逆反應速率都增大,故甲錯誤;
乙:T2>T1,T2先達到平衡,正反應是放熱反應,升高溫度,平衡向逆反應方向移動,則NO2的轉化率降低,故乙正確;
丙:升高溫度,平衡向逆反應方向移動,CO的體積分數增大,故丙錯誤;
答案選乙;
(3)①根據化學反應速率的數學表達式,v(CO2)=![]() mol/(L·min)=0.015mol/(L·min),根據表格數據,在20min達到平衡,根據化學平衡常數的表達式K=
mol/(L·min)=0.015mol/(L·min),根據表格數據,在20min達到平衡,根據化學平衡常數的表達式K=![]() =
=![]() =
=![]() ;
;
②A、加入活性炭,活性炭為固體,對化學平衡移動無影響,故A錯誤;
B、恒溫恒壓下,充入氬氣,容器的體積增大,組分的濃度降低,故B錯誤;
C、適當縮小容器的體積,組分的濃度增大,故C正確;
D、加入合適的催化劑,催化劑對化學平衡移動無影響,故D錯誤;
答案選C。


科目:高中化學 來源: 題型:
【題目】5﹣二甲氧基苯酚是重要的有機合成中間體,可用于天然物質白檸檬素的合成,一種以間苯三酚為原料的合成反應如下:

甲醇、乙醚和3,5﹣二甲氧基苯酚的部分物理性質見下表:
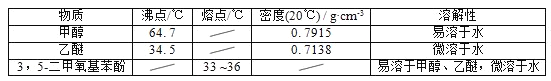
(1)反應結束后,先分離出甲醇,再加入乙醚進行萃取,①分離出甲醇的操作是的______;②萃取用到的分液漏斗使用前需__________________并洗凈,分液時有機層在分液漏斗的________填(“上”或“下”)層;
(2)分離得到的有機層依次用飽和NaHCO3溶液、飽和食鹽水、少量蒸餾水進行洗滌.用飽和NaHCO3溶液洗滌的目的是__,用飽和食鹽水洗滌的目的是______;
(3)洗滌完成后,通過以下操作分離、提純產物,正確的操作順序是__(填字母);
a.蒸餾除去乙醚 b.重結晶 c.過濾除去干燥劑 d.加入無水CaCl2干燥
(4)固液分離常采用減壓過濾.為了防止倒吸,減壓過濾完成后應先________________,再______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學反應的能量變化如下圖所示。下列有關敘述正確的是
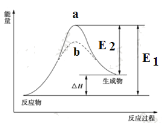
A. 該反應的焓變ΔH=E2-E1
B. a、b分別對應有催化劑和無催化劑的能量變化
C. 催化劑能改變反應的焓變
D. 催化劑能降低反應的活化能
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知反應A(g)+B(g) ![]() C(g)+D(g)的平衡常數K值與溫度的關系如表所示,830 ℃時,向一個2 L的密閉容器中充入0.20 mol A和0.20 mol B,10 s時達平衡。下列說法不正確的是
C(g)+D(g)的平衡常數K值與溫度的關系如表所示,830 ℃時,向一個2 L的密閉容器中充入0.20 mol A和0.20 mol B,10 s時達平衡。下列說法不正確的是
溫度/℃ | 700 | 830 | 1200 |
K值 | 1.7 | 1.0 | 0.4 |
A. 達到平衡后,B的轉化率為50%
B. 增大壓強,正、逆反應速率均加快
C. 該反應為吸熱反應,升高溫度,平衡正向移動
D. 反應初始至平衡,A的平均反應速率v(A)=0.005 mol·L-1·s-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 增加固體反應物的質量,反應速率一定加快
B. 鎂與稀鹽酸反應時,加入適量的氯化鉀溶液,生成氫氣的速率不變
C. 對于可逆反應,升高反應體系溫度,正反應速率和逆反應速率均增加
D. A(g)+B(g)![]() C(g)+D(g),恒溫恒容充入 He 以增大壓強,化學反應速率加快
C(g)+D(g),恒溫恒容充入 He 以增大壓強,化學反應速率加快
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列化學反應中,屬于氧化還原反應的是
A.Al2O3+6HCl=2AlCl3+3H2O
B.Cu+2H2SO4(濃)![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
C.2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
D.SiO2+2NaOH=Na2SiO3+H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究和深度開發CO、CO2的應用對構建生態文明社會具有重要的意義。
(1)CO可用于煉鐵,已知:
Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH1=+489.0 kJ·mol-1,
C(s) +CO2(g)=2CO(g) ΔH2=+172.5kJ·mol-1
則CO(g)還原Fe2O3(s)的熱化學方程式為____。
(2)分離高爐煤氣得到的CO與空氣可設計成燃料電池(以KOH溶液為電解液)。寫出該電池的負極反應式:_____。
(3)將CO2和H2充入1L的密閉容器中,在兩種溫度下發生反應:
CO2(g) +3H2(g)![]() CH3OH(g) +H2O(g)測得CH3OH的物質的量隨時間的變化見圖1。
CH3OH(g) +H2O(g)測得CH3OH的物質的量隨時間的變化見圖1。
①該反應的平衡常數表達式為K=___。
②曲線I、Ⅱ對應的平衡常數大小關系為KⅠ___KⅡ(填“>”或“=”或“<”)。
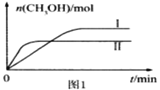
③一定溫度下,往該容器中投入1 molCO2、3 mol H2 ,一段時間后達到平衡。若平衡后氣體的壓強為開始的0.8倍,則CO2的平衡轉化率=____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對圖中的表述中正確的是( )
A.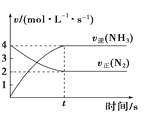 圖中兩條線的交點可表示反應N2(g)+3H2(g)2NH3(g)達到了平衡
圖中兩條線的交點可表示反應N2(g)+3H2(g)2NH3(g)達到了平衡
B. 圖中所介紹的電池使用后埋入地下會污染土壤,應投入火中焚燒徹底銷毀
圖中所介紹的電池使用后埋入地下會污染土壤,應投入火中焚燒徹底銷毀
C.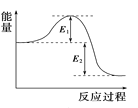 圖可表示某化學反應屬于放熱反應,放出的能量為E1+E2
圖可表示某化學反應屬于放熱反應,放出的能量為E1+E2
D.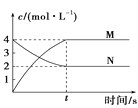 圖涉及的反應可能為N(aq)2M(aq)
圖涉及的反應可能為N(aq)2M(aq)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】依據如圖判斷,下列說法正確的是( )
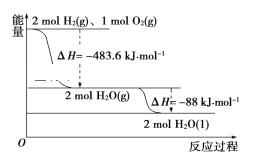
A. 氫氣的燃燒熱ΔH=-241.8 kJ·mol-1
B. 2 mol H2(g)與1mol O2(g)所具有的總能量比2 mol H2O(g)所具有的總能量低
C. 液態水分解的熱化學方程式為2H2O(l)=2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
D. H2O(g)生成H2O(l)時,斷鍵吸收的能量小于成鍵放出的能量
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com